Hallo zusammen,
am letzten Samstag war ich mal wieder im NSG Borkenberge an der Grenze zwischen Haltern und Coesfeld unterwegs. Es handelt sich um einen ehemaligen Truppenübungsplatz, der mittlerweile zum Naturschutzgebiet umfunktioniert wurde. Es dort auf sandigem Boden viele Kiefern, aber auch Birken und an einigen Stellen Eichen und Buchen. Also sehr reichhaltig, was den Baumbestand angeht. Dazu kommen dann noch offene Heideflächen. Die sind zwar leider nicht zugängig, da es ein Wegegebot gibt (wohl auch wegen möglicher Blindgänger, die dort noch schlummern), das auch kontrolliert wird (wohl weniger wegen Pilzsammlern als eher wegen Quadfahrern). Aber selbst wenn man nur entlang der freigegebenen Straße unterwegs ist, findet man deutlich mehr Pilze, als man sinnvoll bearbeiten kann.
1. Eine Telamonie unter Eiche, Buche, Birke und Kiefer. Eigentlich sollte man sich sowas ja gar nicht erst anschauen, aber es war der Anfang der Tour, der Sammelkoffer war leer und es gab eine Kollektion mit Pilzen von alt bis jung. Geruch war erdig-muffig. Dann also mal die FN rausgeholt und geschlüsselt. Und bei der Fruchtkörpergröße geht es schon los. Die meisten sind ja eher klein, aber der alte Schlappen ist schon größer als 3 cm Hutddurchmesser und 4 mm Stieldicke. Wie biegt man da ab? Oder sollte man mal in beide Richtungen gehen?
Ansonsten wird im Schlüssel noch nach der Velumsfarbe gefragt, die würde ich hier als weiß bezeichnen. Geht ihr da mit?
Sporengröße (8.2+-0.6) µm x (5.0+-0.2) µm, Q=1.7+-0.2 bzw. (7.2-9.5) µm x (4.5-5.4) µm, Q=1.4-1.9




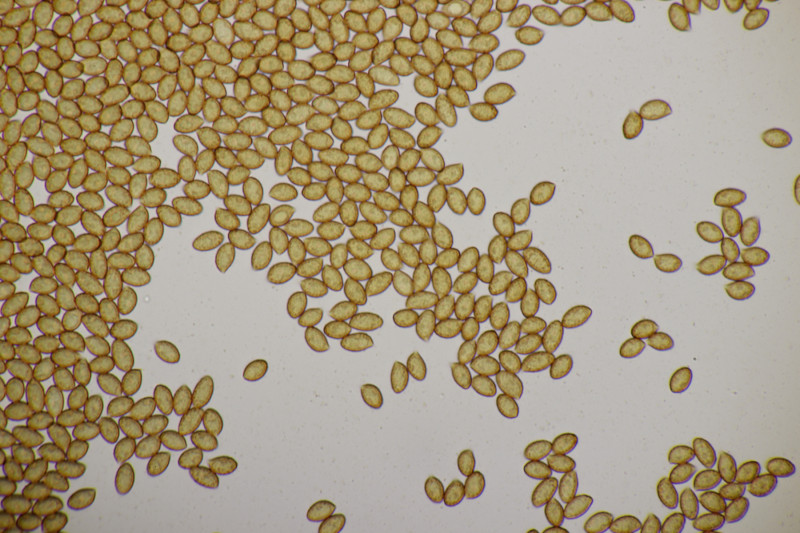


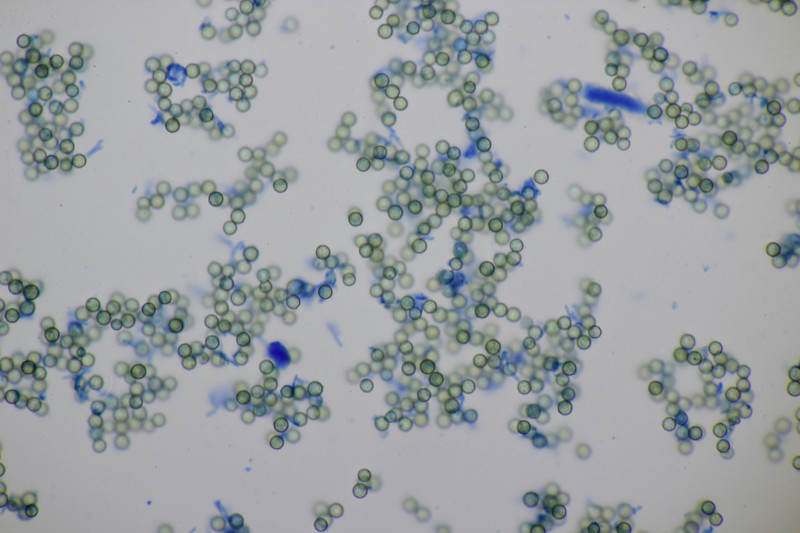
2. Ein Stäubling. Da ich neben Capilitum auch Paracapilitium gefunden habe, würde ich den als Lycopderon pratense ablegen. Was meint ihr? Sporengröße (3.6+-0.2) µm bzw. (3.1-4.0) µm, Sporen fein warzig.


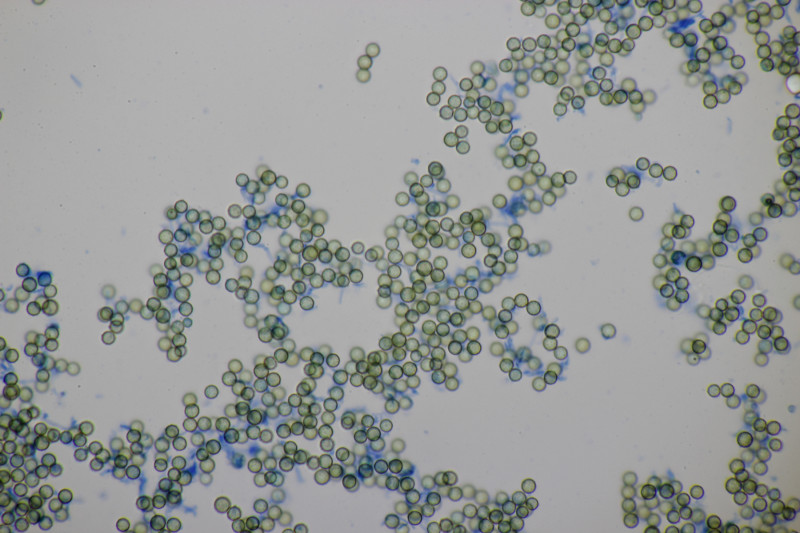
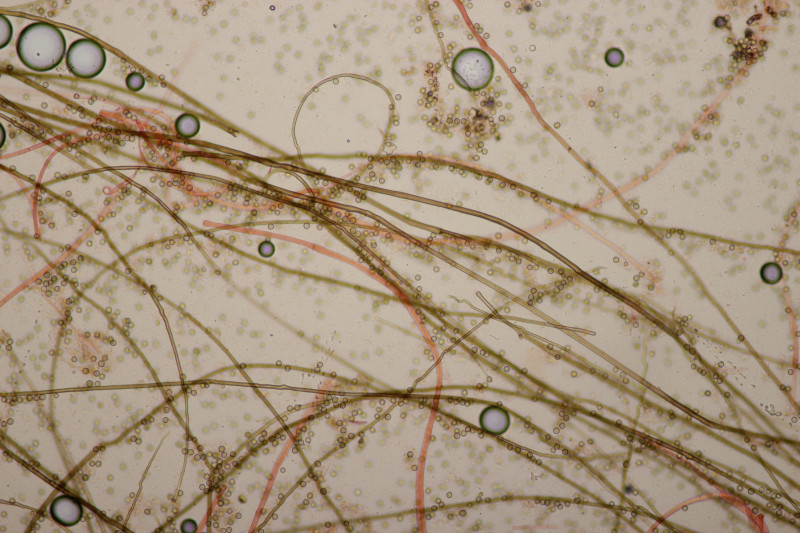

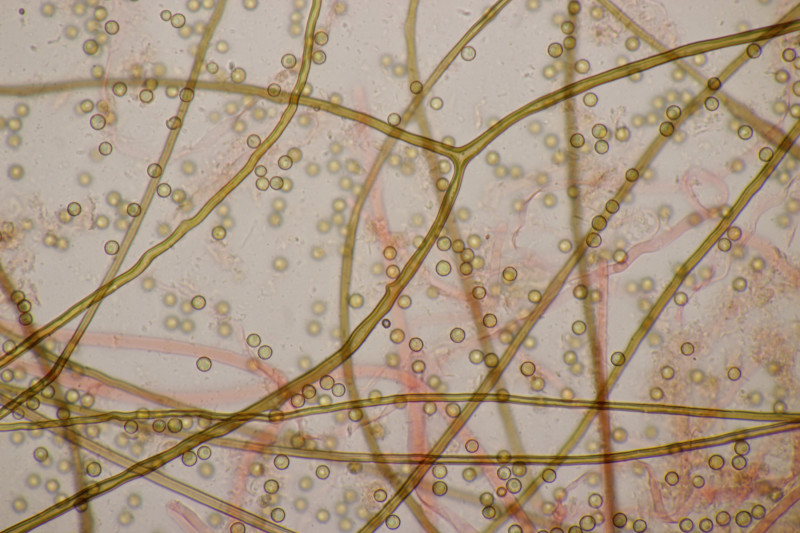
3. Ein Täubling, Geschmack mild, leicht mehlig (wie ein mehliger Apfel) in der Konsistenz, mit Guajak nach 8 Sekunden ganz langsam bläuend, mit Eisensulfat orange, Sporenpulver IIIb, Begleitbäume Betula und Quercus. Ich muß gestehen, daß ich da aus Zeitgründen noch keinen Bestimmungsversuch unternommen habe, aber vielleicht hat ja jemand eine Idee dazu.


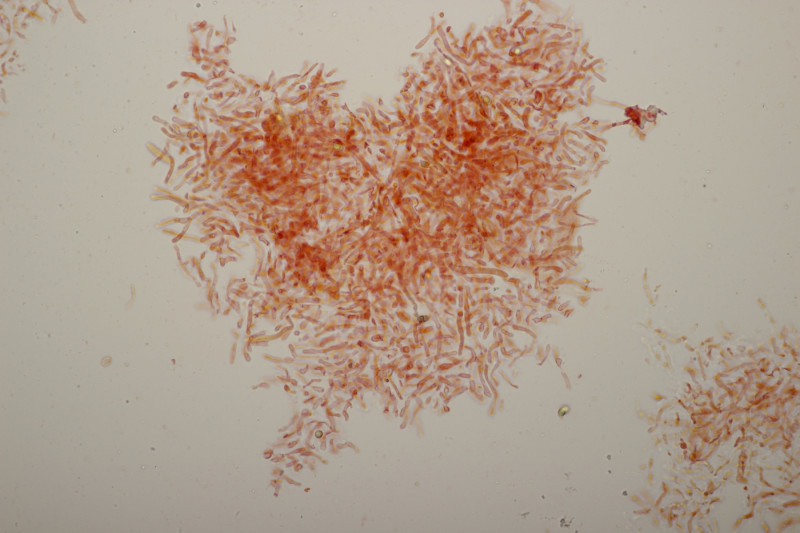

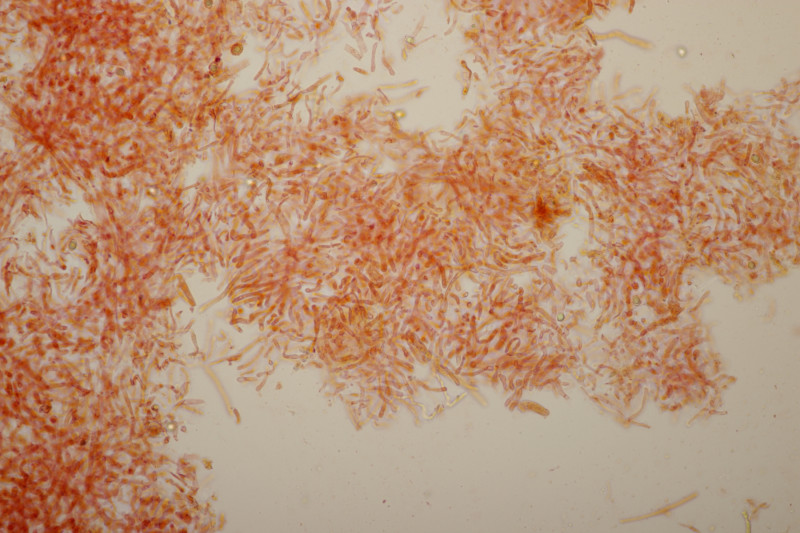

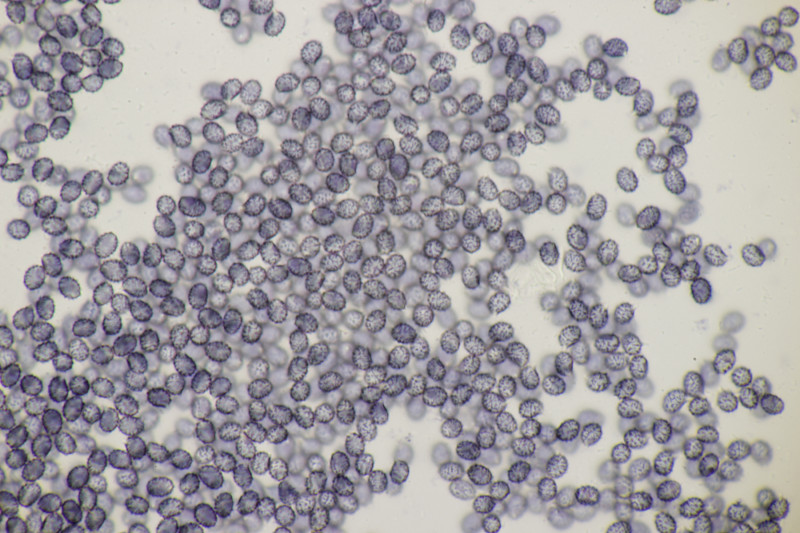
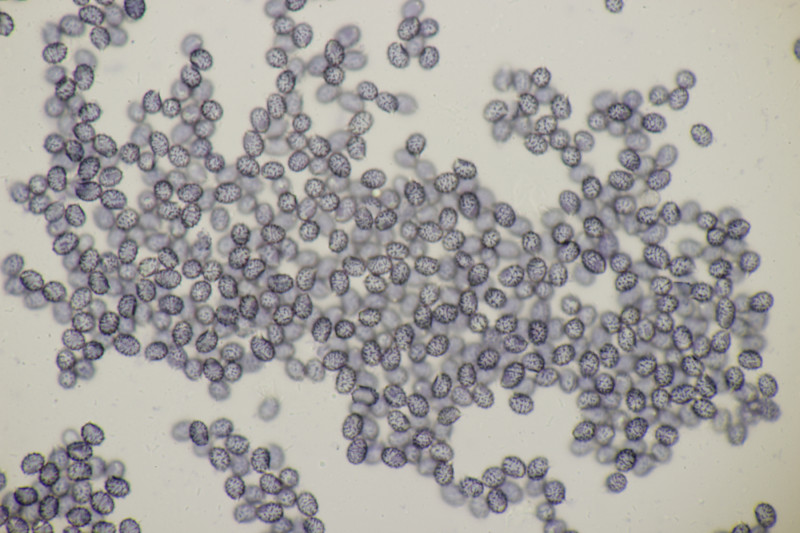
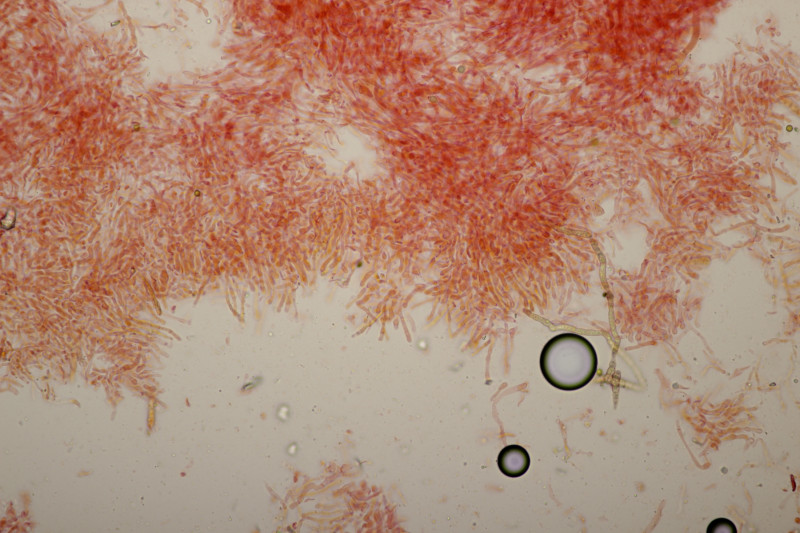
4. Noch ein Täubling. Ebenfalls mild, mit Guajak nach 5 Sekunden deutlich blau werdend, Eisensulfat orange, Sporenpulver IIIb, Begleitbäume Quercus und Betula. Auch hier aus Zeitgründen noch kein Bestimmungsversuch meinerseits.

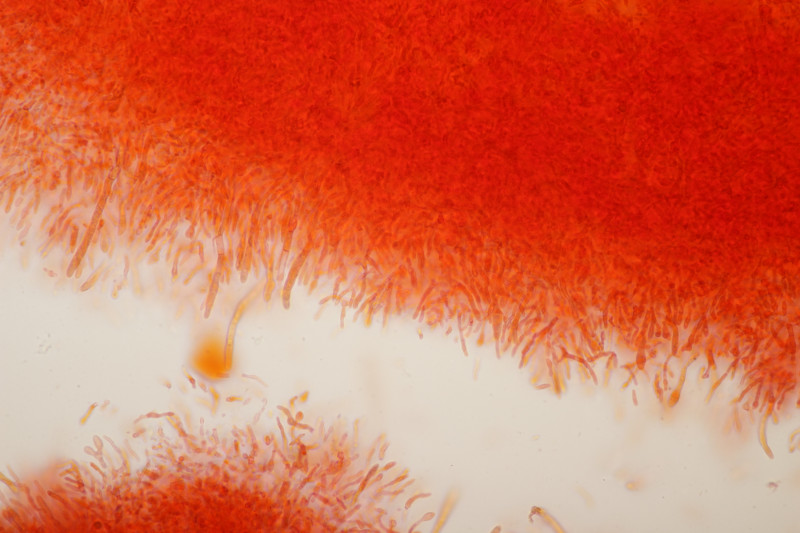

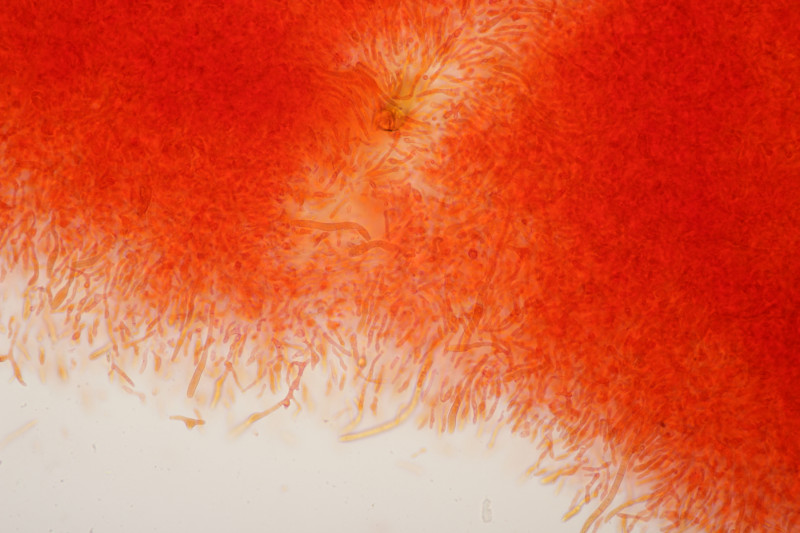
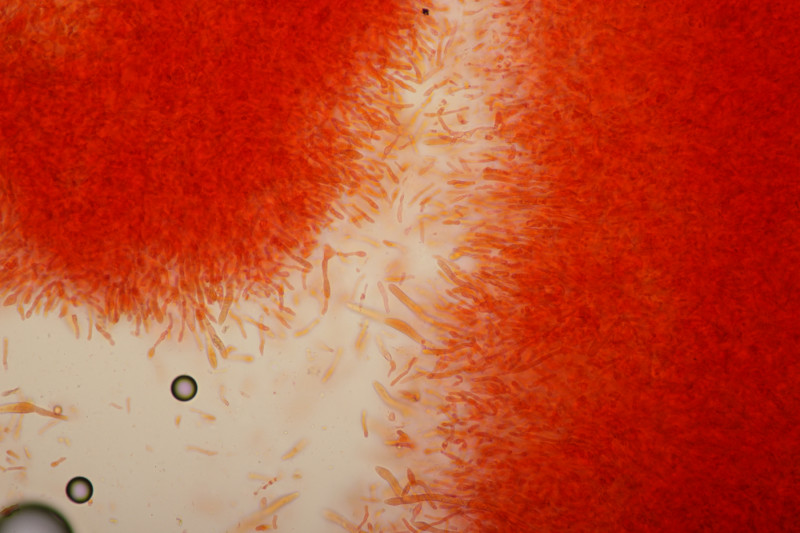
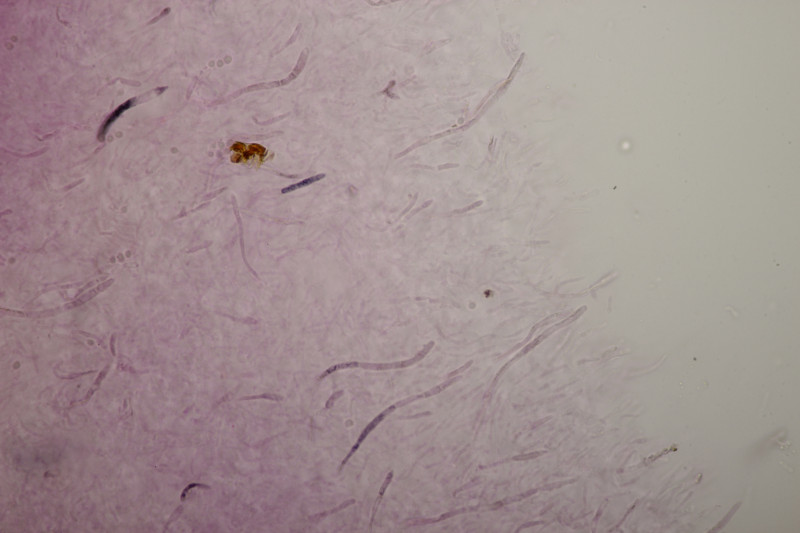
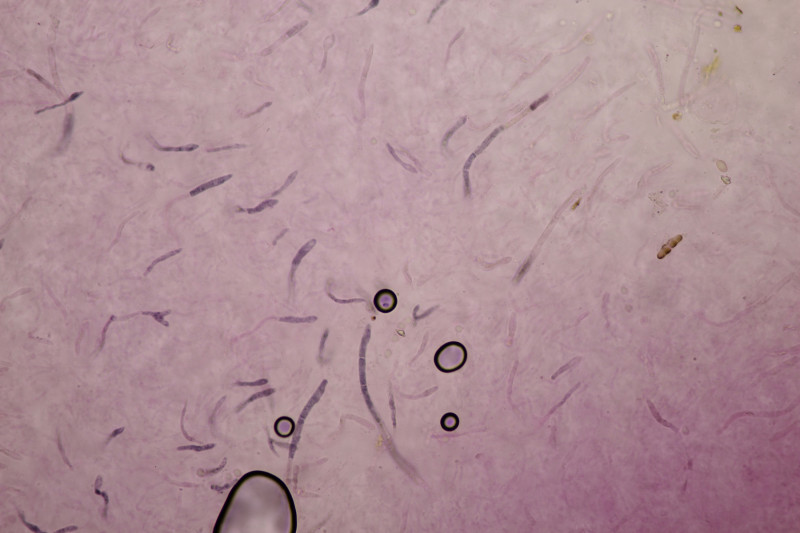
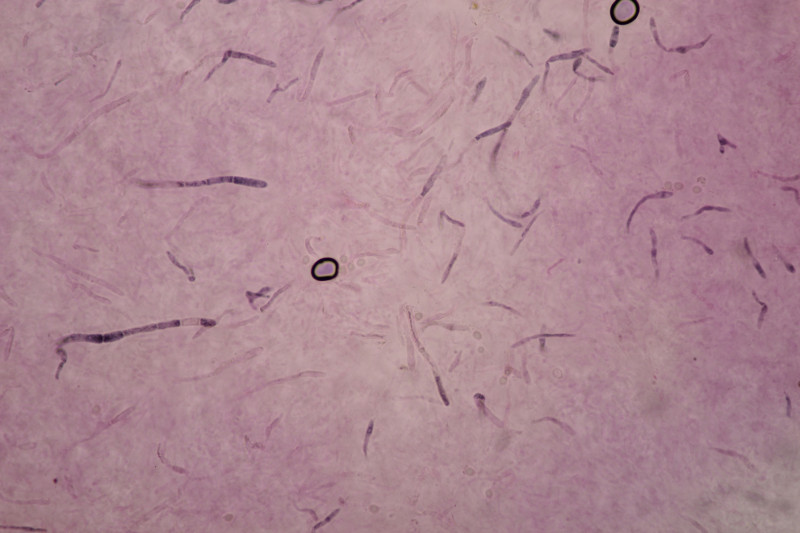


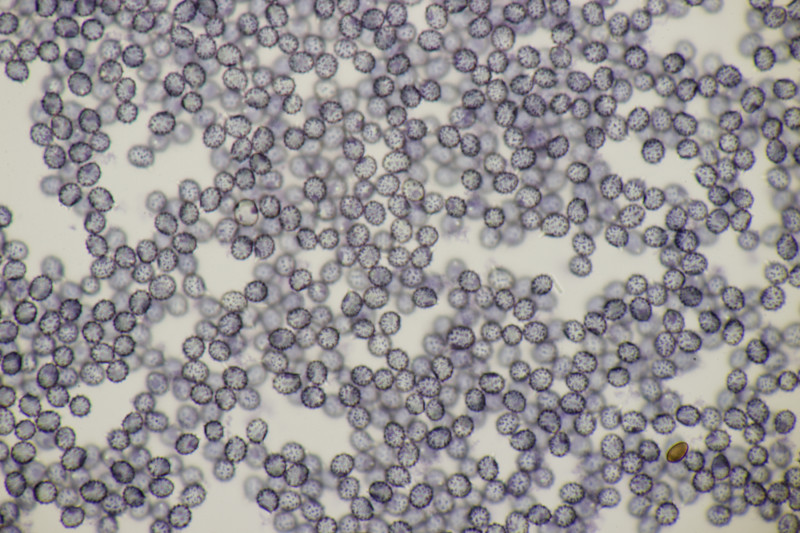
5. Cystoderma amianthinum, Sporengröße (6.0+-0.5) µm x (3.4+-0.2) µm, Q=1.7+-0.2 bzw. (5.4-7.1) µm x (3.2-3.9) µm, Q=1.4-2.1


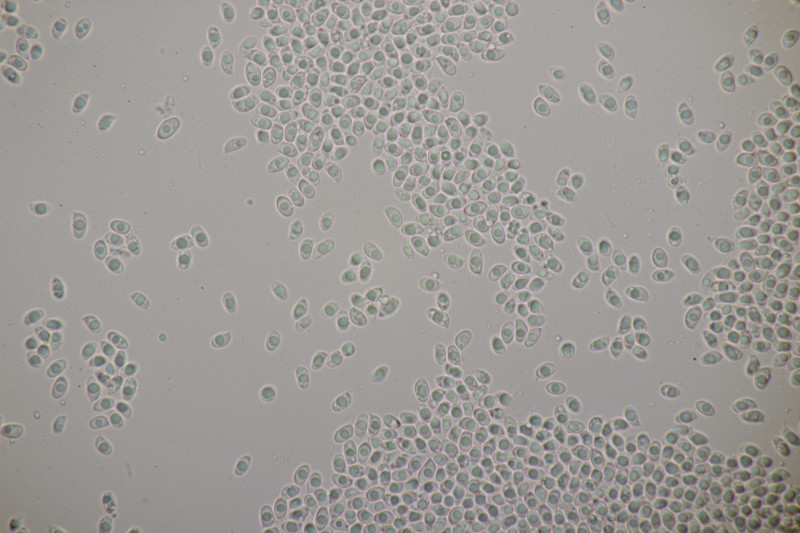
Huthaut
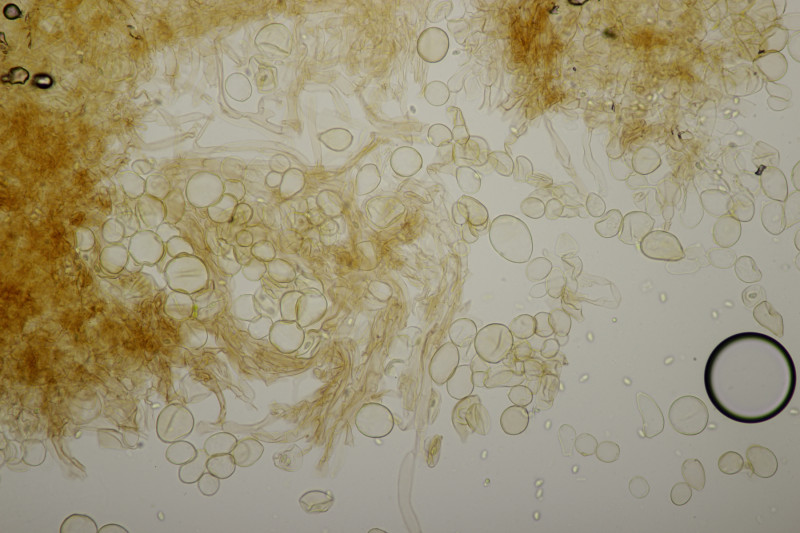
6. Ein dicker, fetter Stäubling. Aber welcher genau? Der Durchmesser war so geschätzt 15-20 cm.

7. Hygrocybe conica. Als ich den Pilz fotografierte, kam ein Radfahrer vorbei, der neugierig fragte, was ich da suche. Ich hub an, von Pilzen zu erzählen, woraufhin er sofort feststellte: Das sind dann aber kleine Pilze!?! Ich stimmte zu und verwies auf den farbenfrohen, seltenen und geschützen Saftling, aber er fuhr fort: Es gibt ja auch halluzinoge Pilze... ich hab da letztens ein Buch gelesen....

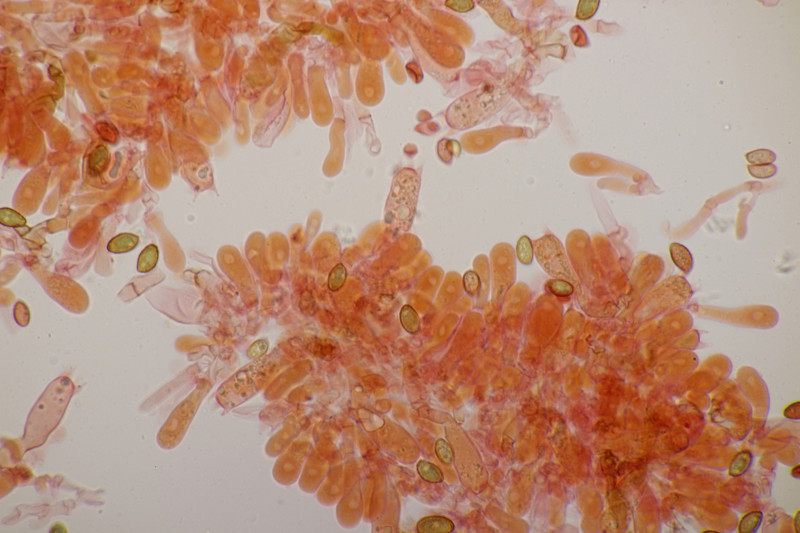
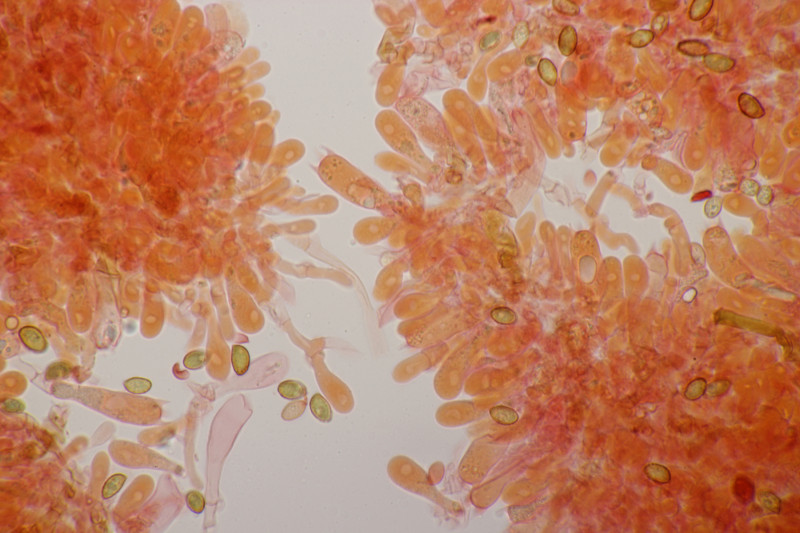
8. Neottiella vivida, Sporen (25-28) µm x (16-17) µm, Q=1.4-1.7








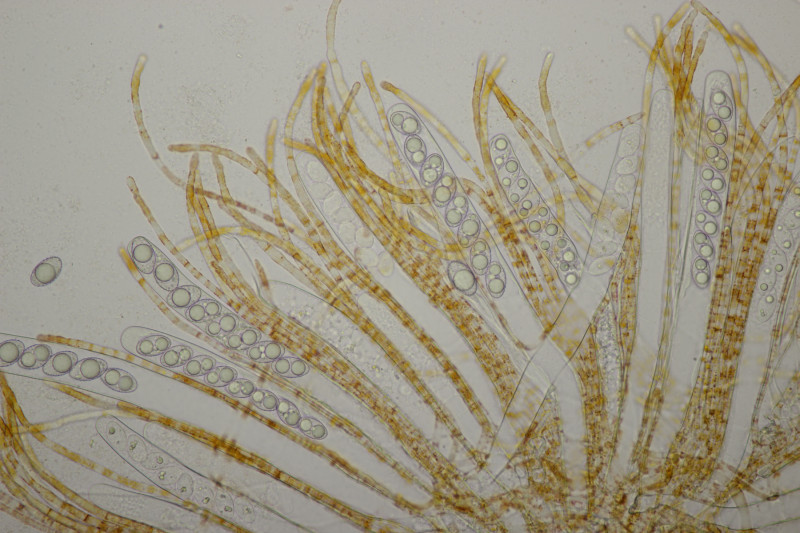
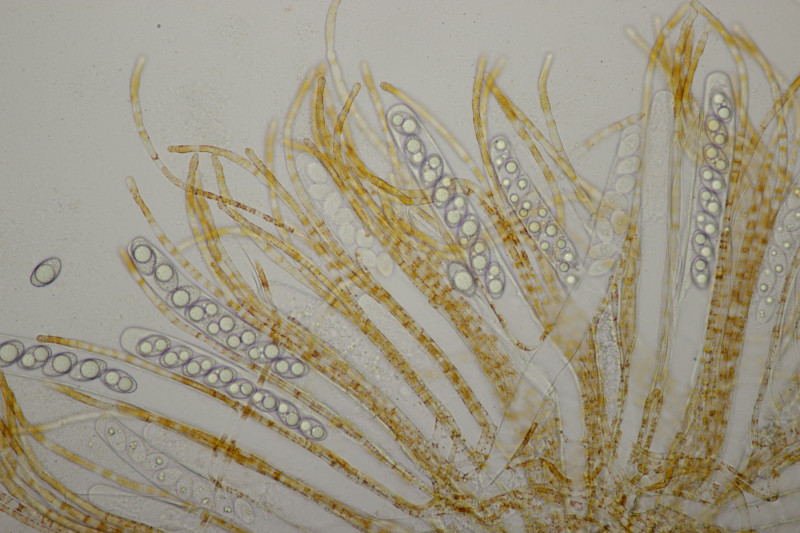




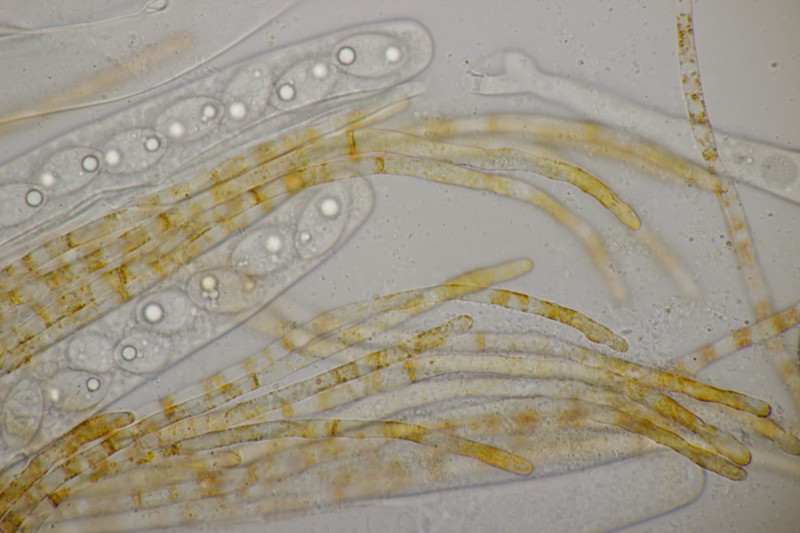
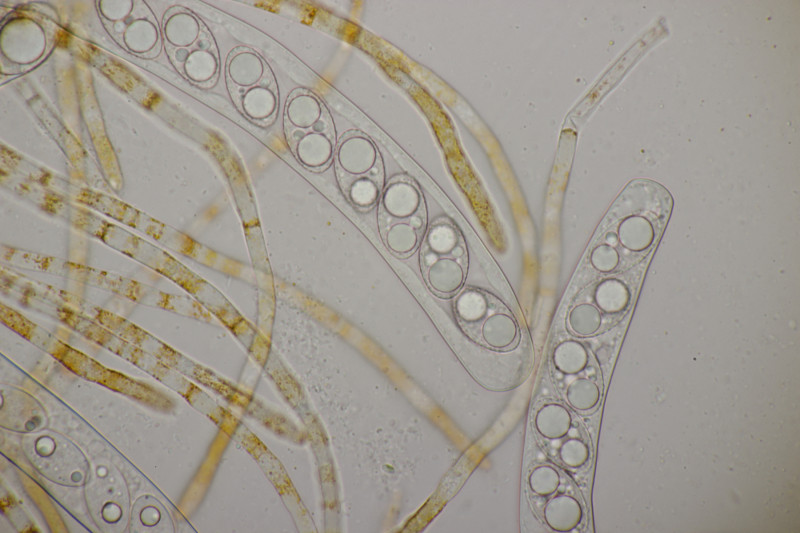
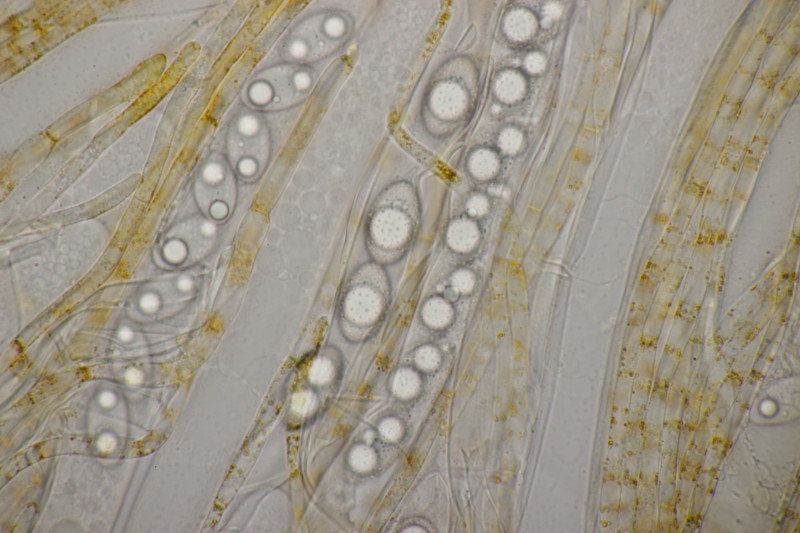
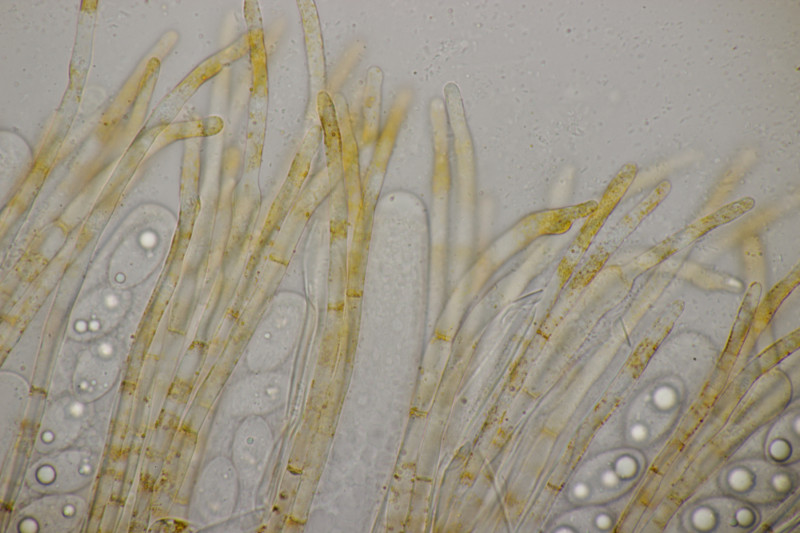
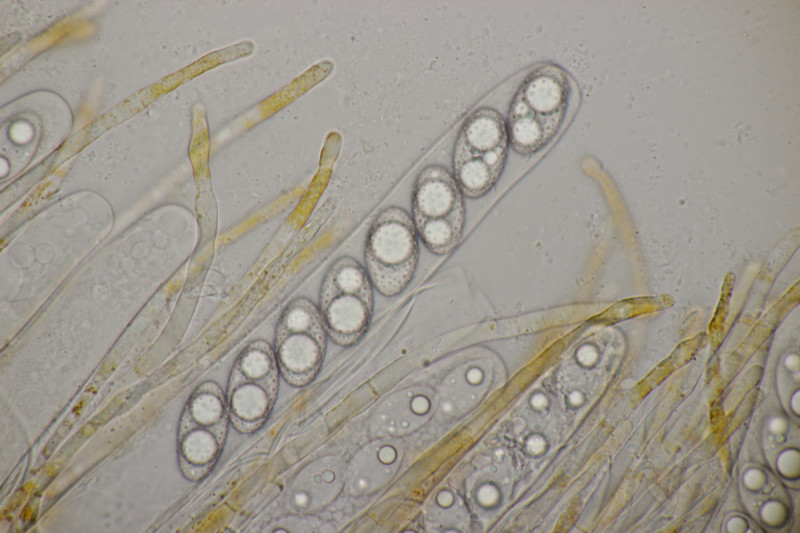

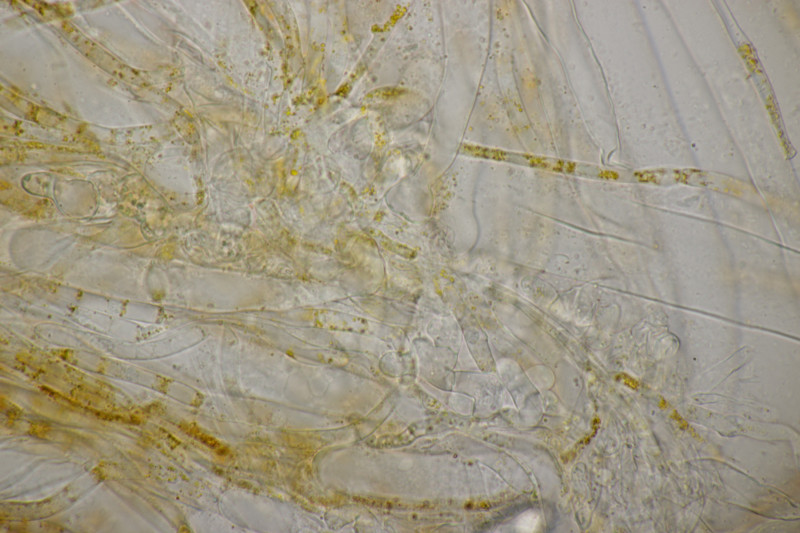
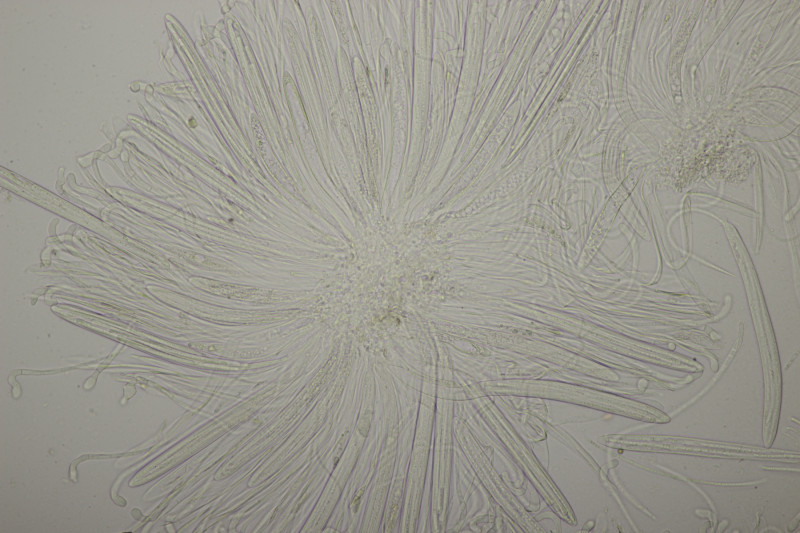
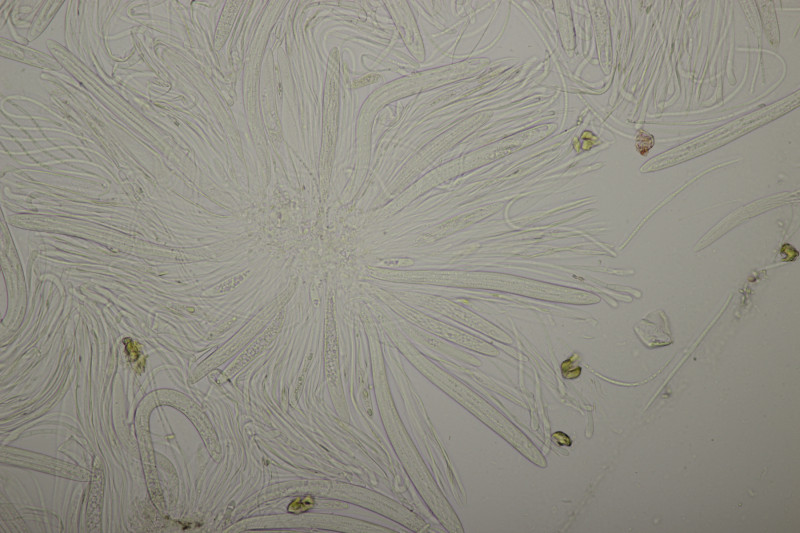
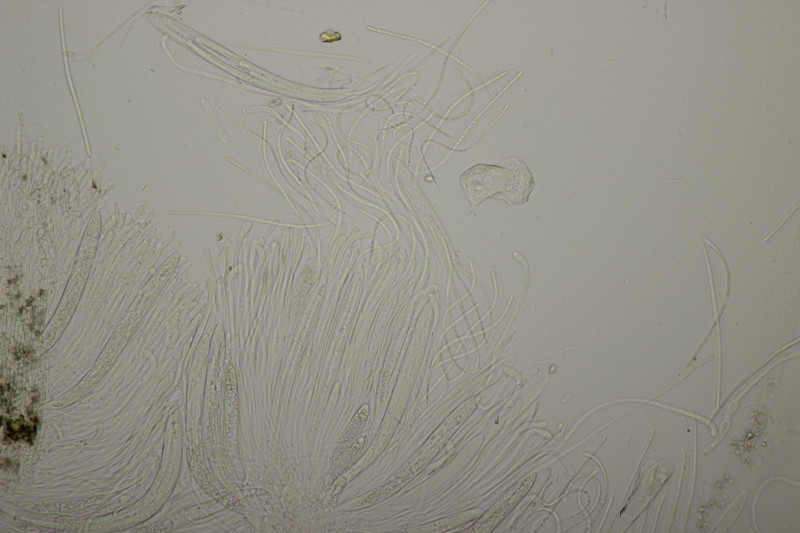
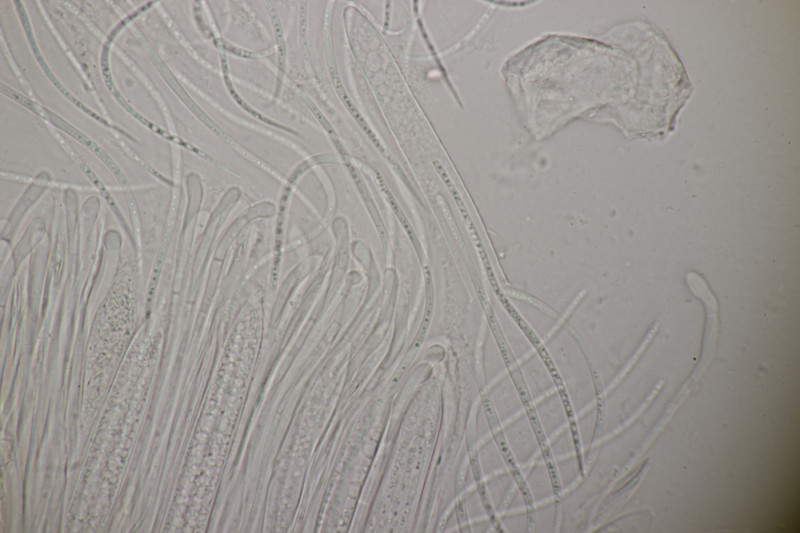
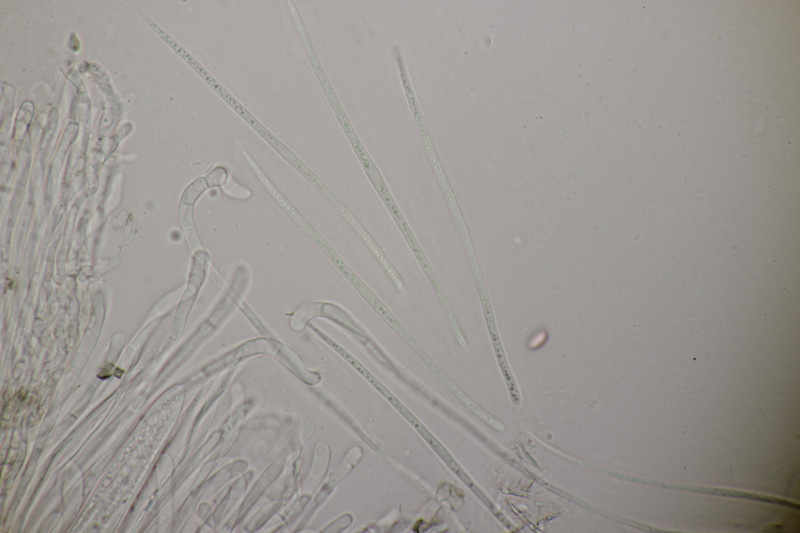
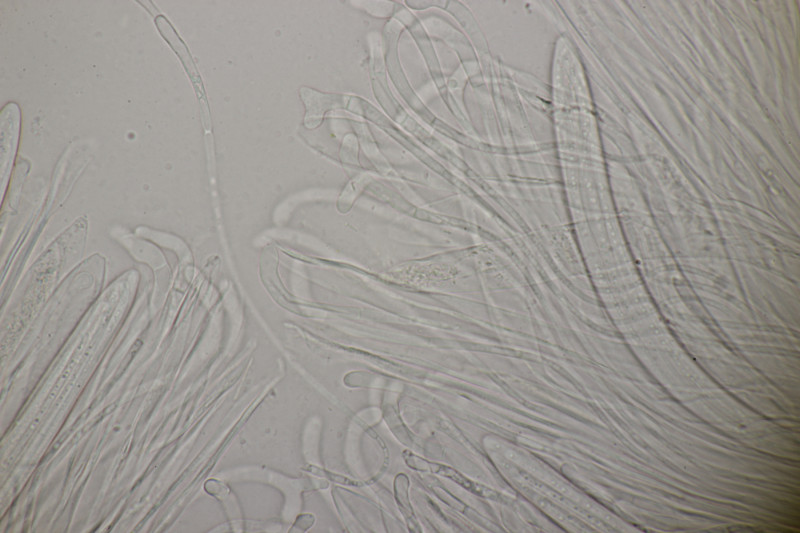
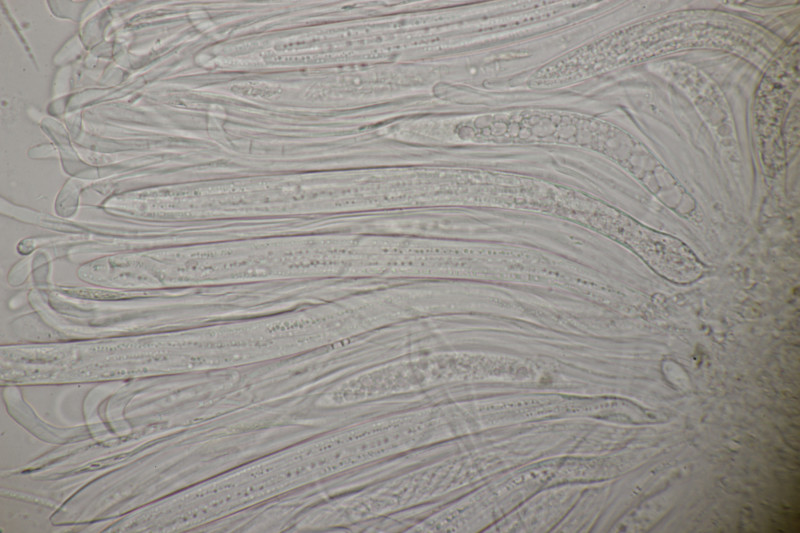
9. Eine Spaltlippe an Pinus sylvestris. Sporen um die 105 µm lang, Asci 160-170 µm. Auch wenn hier die Querstreifen fehlen, würde ich zu Lophodermium pinastri tendieren, da die Nadel nicht mehr an toten Ästen war und die Sporen für L. pini-excelsae zu groß sind.




Björn


