Hallo zusammen,
Zitat
Klassische Art des Winterhalbjahres! Die wirst Du im Sommer nicht entdecken, Björn.
Daran kann es eigentlich nicht liegen. Im Sommer mache ich ja fast nur Phytoparasiten und der Dung ist dann dem Winter vorbehalten. Wobei ich da jetzt auf meiner Probe unzählige Ascobolus-Fruchtkörper hatte und nur ganze wenige davon waren A. brassicae (ich kann also nicht mal mit Sicherheit sagen, wie der makroskopisch aussah). Kann also auch sein, daß man den im Gewusel einfach mal übersieht.
Zitat
Passt, falls nur mit einem einzigen Ascus pro Fruchtkörper. Ansonsten wäre Thelebolus nanus noch eine Option, falls es die Art wirklich gibt. Was ich anzweifle.
Für mehr als einen Ascus pro Fruchtkörper war da wahrlich kein Platz  Also ist Th. nanus raus.
Also ist Th. nanus raus.
Mittlerweile hat der Osterhase ganz ordentlich nachgelegt. Zunächst mal ein paar makroskopische Impressionen:




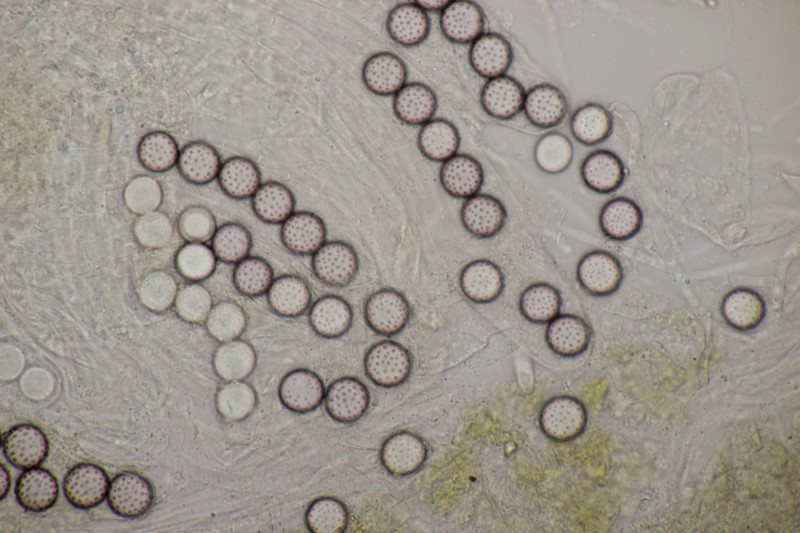
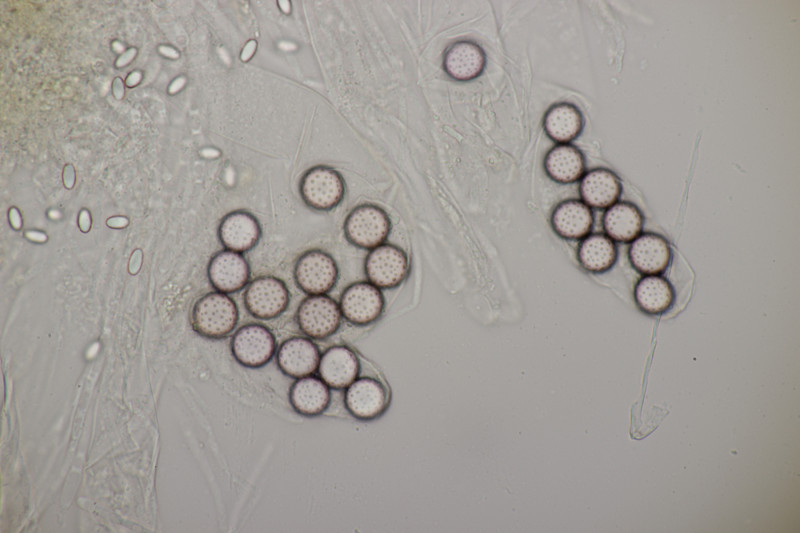
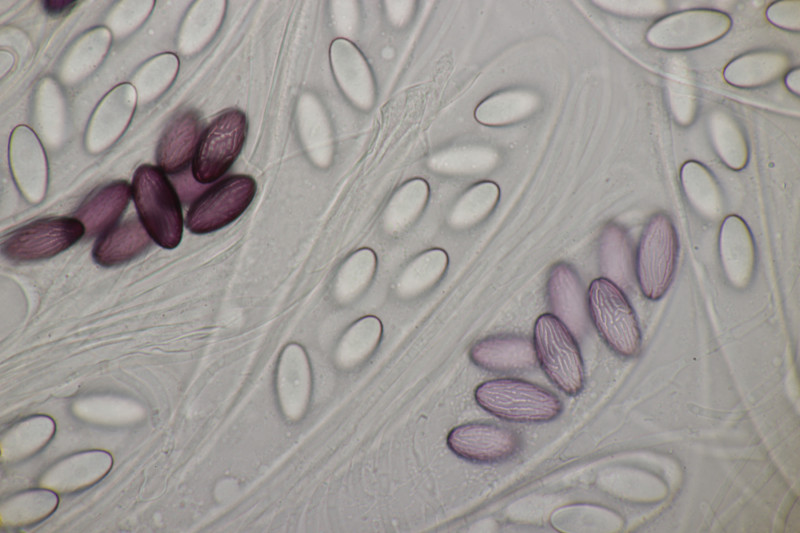
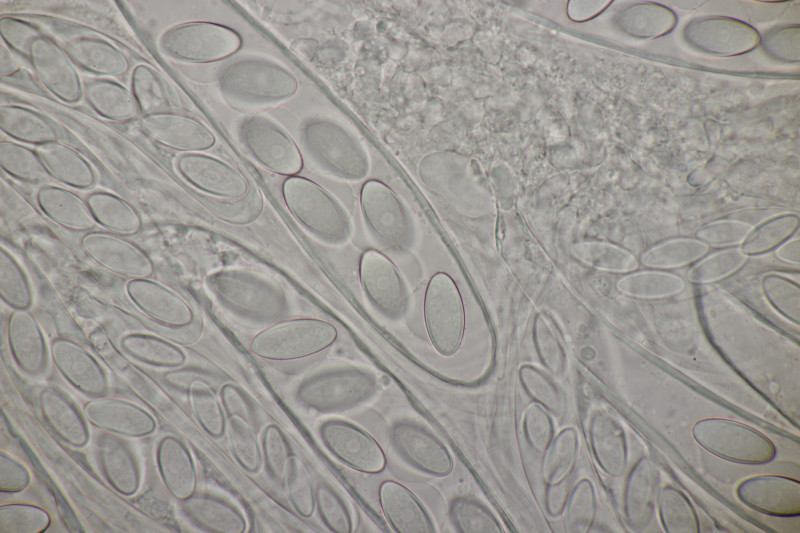
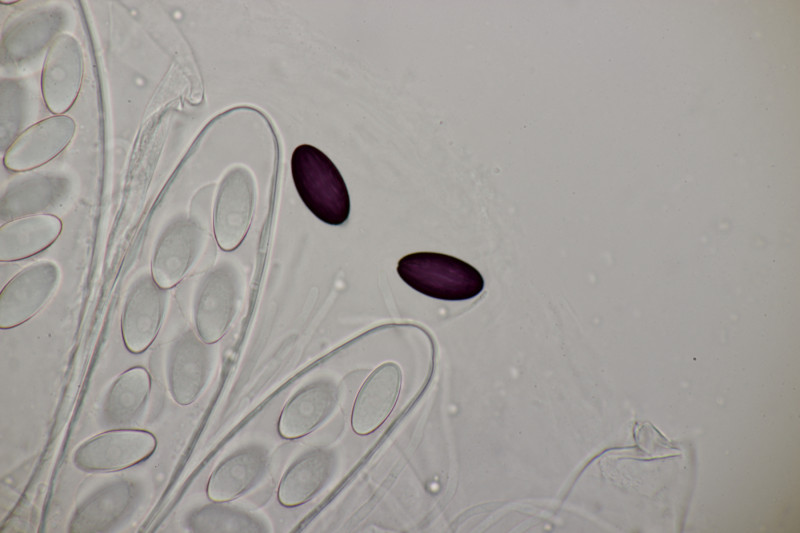
1. Zunächst noch mal ein paar weitere Bilder von Ascobolus brassicae, weil er so hübsch ist.



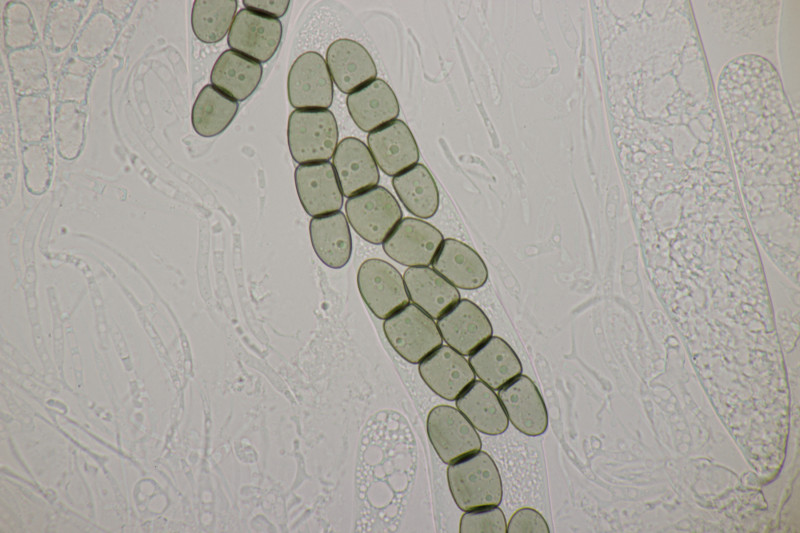
2. Dann gab es eine Sordaria, die ich an aufeinanderfolgenden Tagen in unterschiedlicher Reife erwischt habe. Die vierzelligen Sporen messen (50-60) µm x (9-11) µm. Die Keimspalten erscheinen sförmig gebogen zu sein. Die Perithecien sind nicht haarig. Bei der Beurteilung der Ascusform tue ich mich ja immer etwas schwer, tendiere aber zu abrupt verengten Ascusbasen, was mich dann zu Sporormiella intermedia führt. Die andere Richtung liefe auf S. grandispora hinaus, die aber mit geraden Keimspalten ausscheidet.







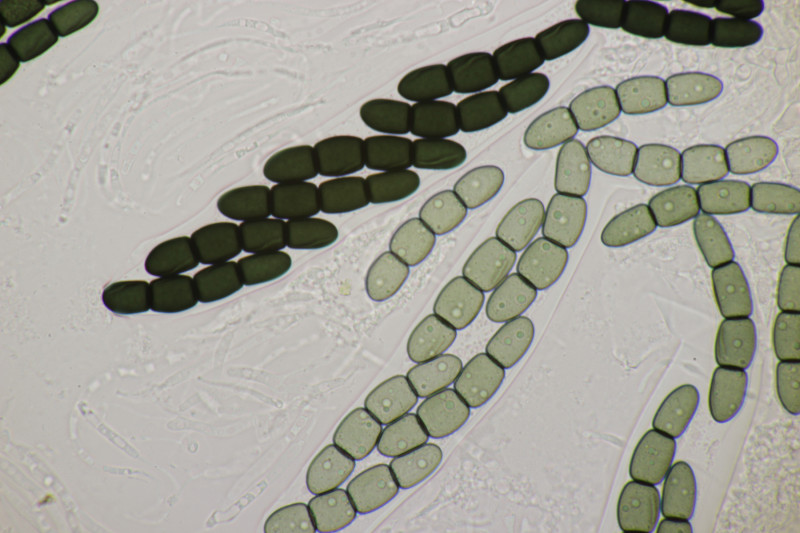

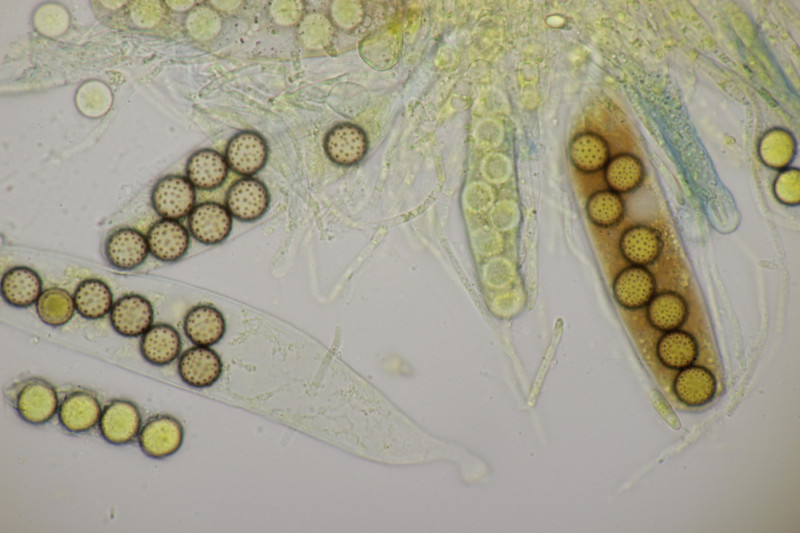
3. Noch mal Thelebolus dubius var. lagopi
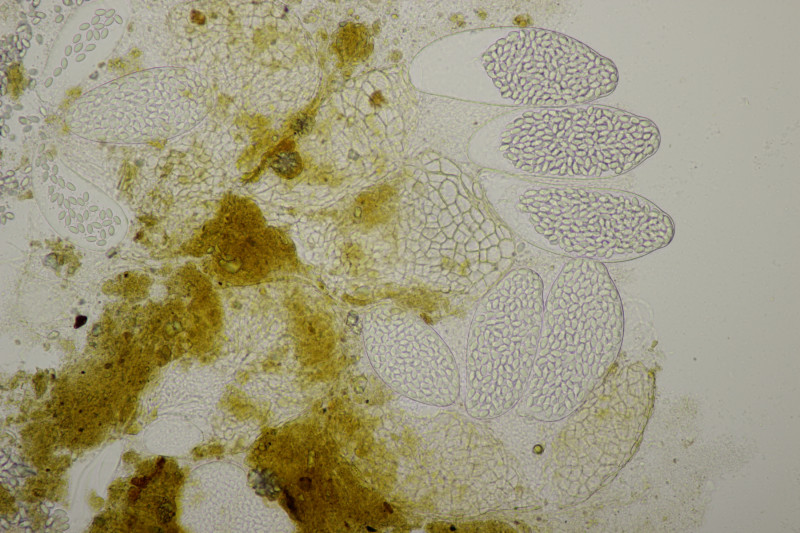



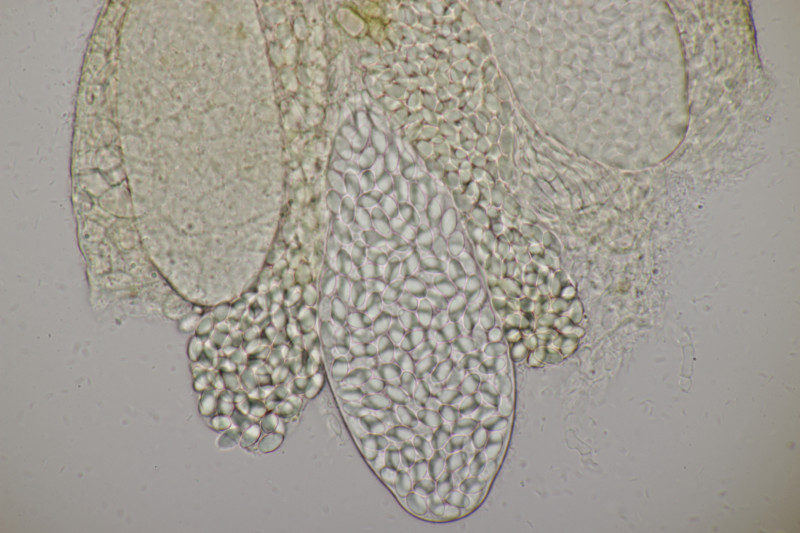
4. Eine Sordaria mit Sporen von 18-21 x 10 µm, so daß ich bei Sordaria fimicola lande






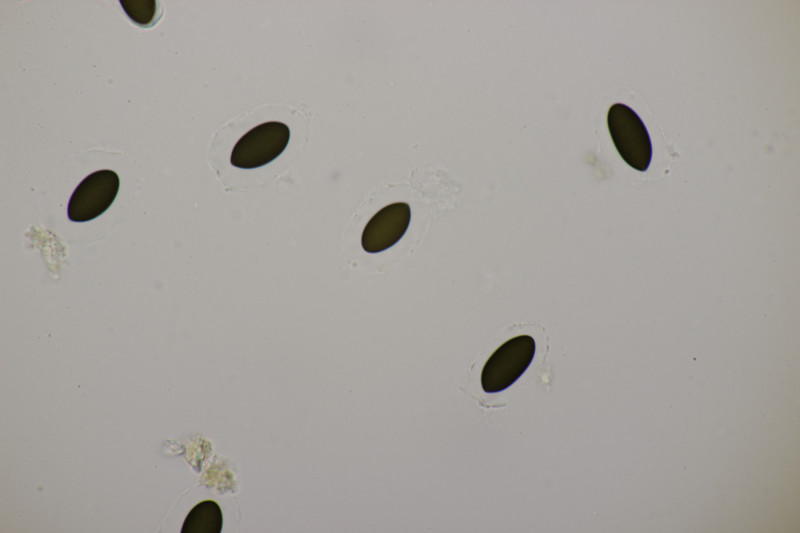

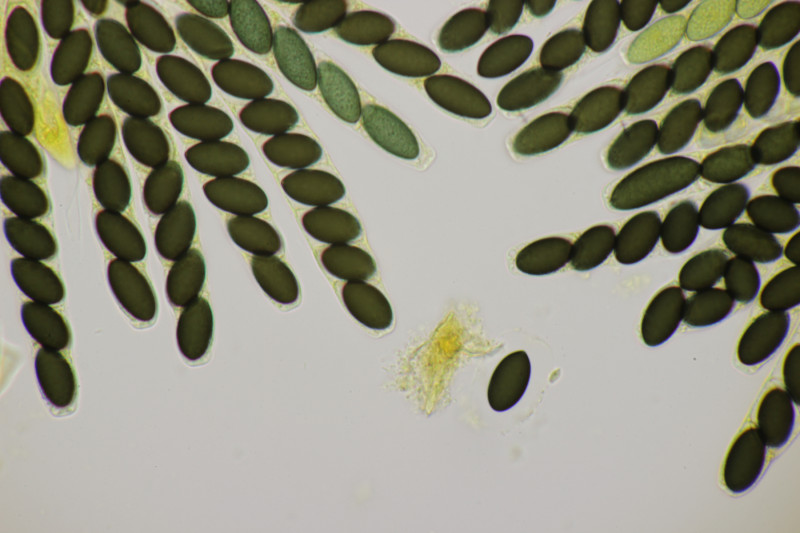
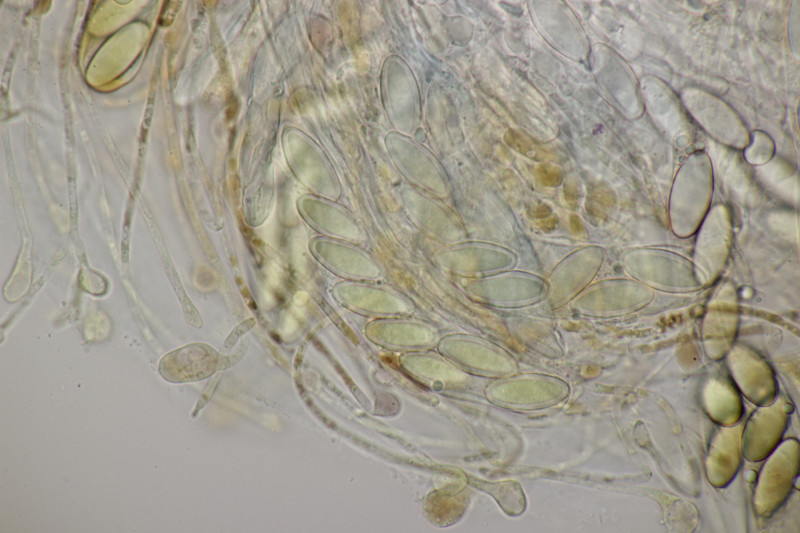
5. Ein Ascozonus mit Sporen von (12.1+-0.8) µm x (3.8+-0.2) µm, Q=3.2+-0.2, (10.9-14.1) µm x (3.3-4.2) µm, Q=2.8-3.6. Die genau Zahl von Sporen im Ascus konnte ich leider nicht ermitteln. Es scheinen aber mehr als 32 Sporen zu sein. Für Ascozonus woolhopensis scheinen die Sporen etwas klein zu sein, wenn man die Angaben im Doveri nimmt. Oder paßt das trotzdem noch? Das wäre ja offenbar die mit Abstand häufigste Art der Gattung bei uns.
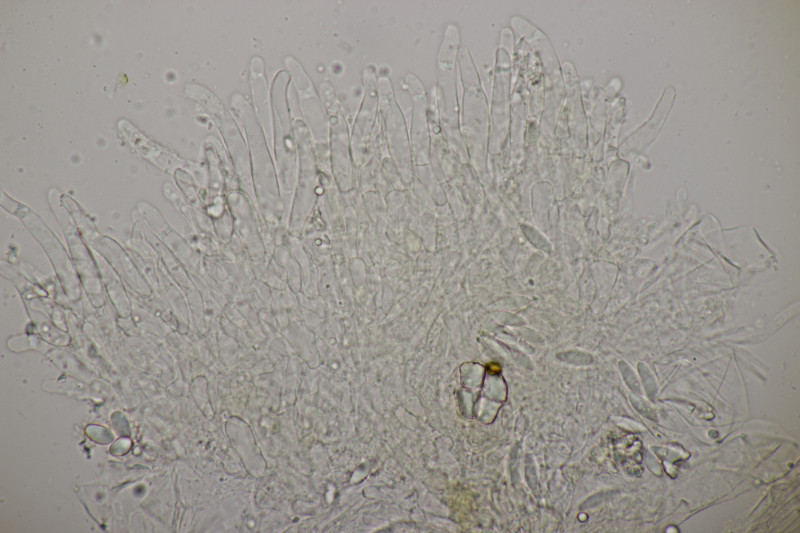


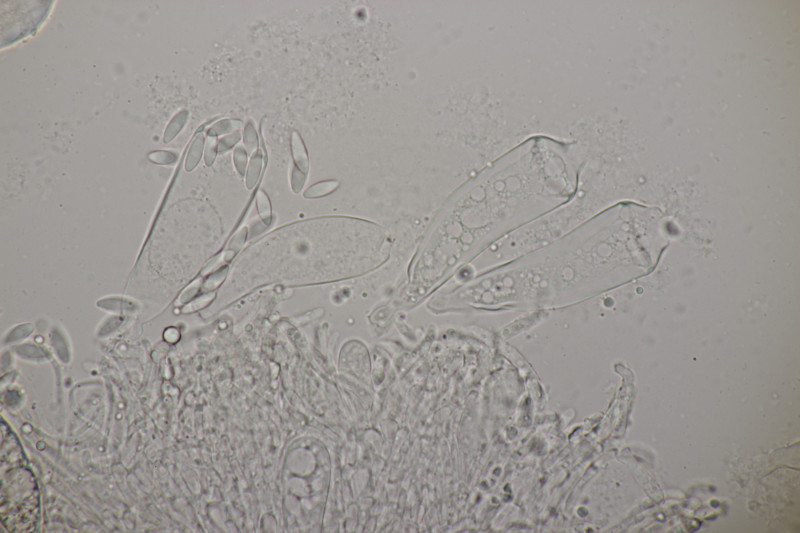
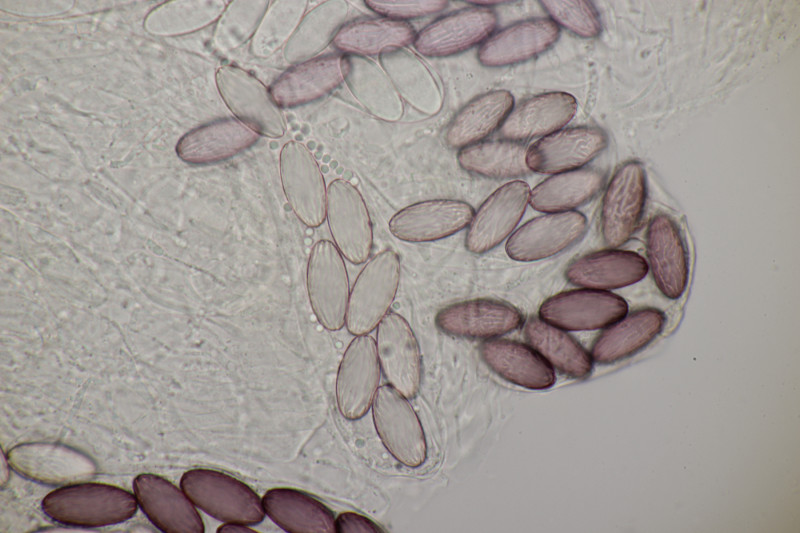
6. Und zum Abschluß noch ein Ascobolus. Die Sporen messen 25 x 12 µm und haben Längsrillen. Die ersten drei Bilder sind ein anderer Fruchtkörper als die restlichen Bilder. Beide Male handelt es sich aber um relativ kleine Fruchtkörper und nicht die großen Brocken, die man oben auf den Fotos sieht. Auffällig sind die oben verdickten Paraphysen des zweiten Fruchtkörpers. Das scheint aber kein Ascobolus zu haben, also denke ich, daß es sich hier um eine Fehlentwicklung handelt. Ich äußere mal eine vorsichtige Tendenz zu A. albidus (auch wenn die Fruchtkörper nicht ganz weiß erschienen).



Björn


