[font="Arial"]25.05.2016: Nur die schönsten fotografiert...
Liebe Schwammer-Freunde,
an diesem Tag machte ich eine recht lange Tour und fand auch viele Pilze. Davon waren aber sehr viele Standards und/oder normale Speisepilze. Deshalb fotografierte ich mal nur die schönsten, bzw. interessantesten Funde. Diese zeige ich Euch wie immer... 
Los geht's...
[/font]
[font="Arial"]Der erste war ein Asco, der sich für mich gar nicht so leicht bestimmen ließ, weil ich zu diesem Zeipunkt noch nicht wusste wie man diese eigentlich präpariert und mounted....
Fundnummer: 2016-05-25-1044
[/font]
[font="Arial"]Makrodaten:
Fundort: ca. 550 müNN. ca. N50, O12, an einem Kraut- oder Grasstängel in sehr feuchtem Gelände
Fundzeit: 25.05.2016
Wuchsform: gesellig
Becher: kegelig, gelb
Stiel: weiß
Stielbasis: minimal behaart
Größe: Becherdurchmesser ca. 0,8-1,5 mm, Höhe 2-3 mm, Stieldurchmesser ca. 0,3 mm
Geruch: nicht feststellbar
[/font]
[font="Arial"]Mikrodaten:
Asci:
8-sporig, Porusreaktion: Melzer schwach blau, apikal oft gebogen, ohne Haken
(75.1) 77 - 90.5 (90.9) x (5) 6.4 - 6.9 (7.1) µm
Q = (10.8) 11.3 - 14.1 (16) ; N = 8
Me = 84.1 x 6.5 µm ; Qe = 13.1
[/font]
[font="Arial"]Paraphysen:
Die Bilder sind wohl nicht sehr aussagekräftig, da ich zu diesem Zeitpunkt noch nicht wusste, dass Chloralhydrat die Tröpfchen stark verändern kann (inzwischen weiß ich das).
In Melzer's war zu sehen :
zylindrisch, fadenförmig, zur Spitze hin verdickt, septiert, vermutlich im Vitalzustand mit vielen Tröpfchen gefüllt.
(1.6) 1.61 - 2.1 (2.4) µm
N = 8
Me = 1.9 µm
[/font]
[font="Arial"]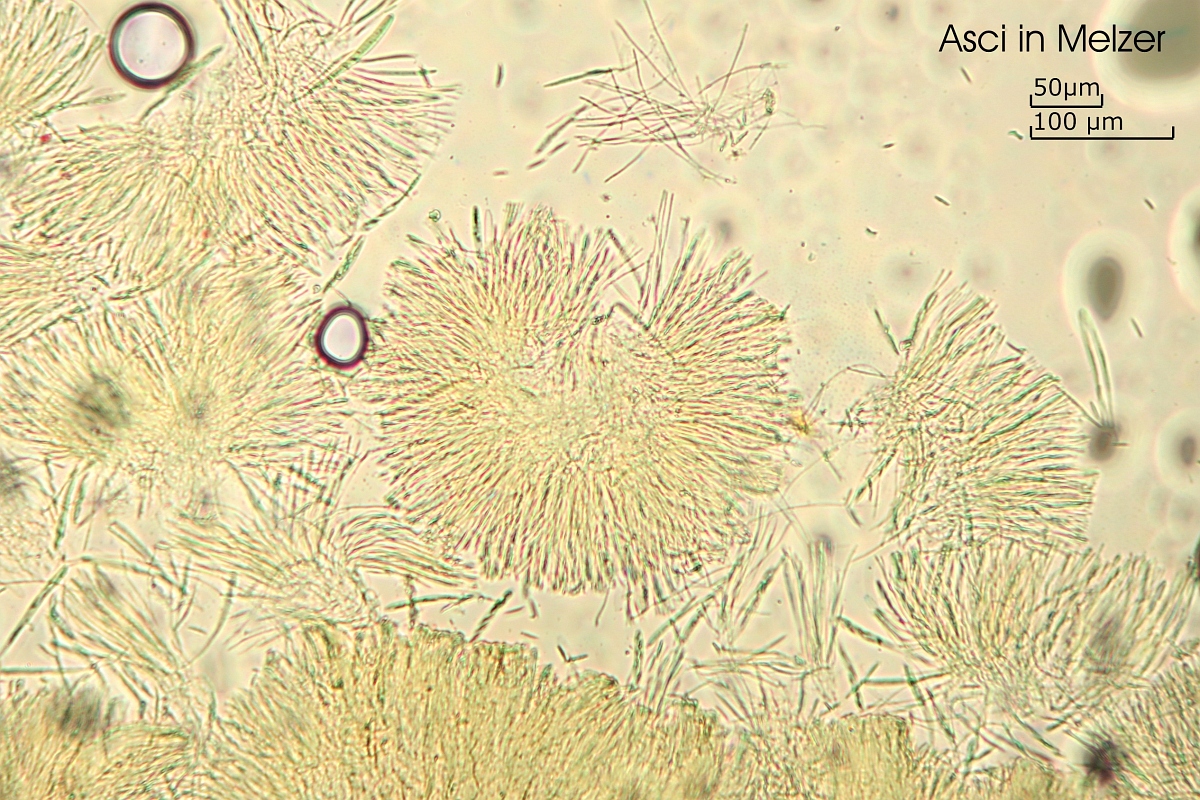
[/font]
[font="Arial"]
[/font]
[font="Arial"]Sporen:
Das Sporenbild ist wohl nicht aussagekräftig, da ich zu diesem Zeitpunkt noch nicht wusste, dass Chloralhydrat die Tröpfchen stark verändern kann (inzwischen weiß ich das).
In Melzer's war zu sehen:
länglich, spindelig bis zylindrisch, unregelmäßige Öltröpfchen, manchmal einfach septiert, OCI = ca. 3-5?
(13.4) 13.8 - 17.2 (18.3) x (2.5) 2.54 - 3.1 (3.2) µm
Q = (4.8) 5.1 - 6.2 (6.6) ; N = 21
Me = 15.6 x 2.8 µm ; Qe = 5.6
[/font]
[font="Arial"]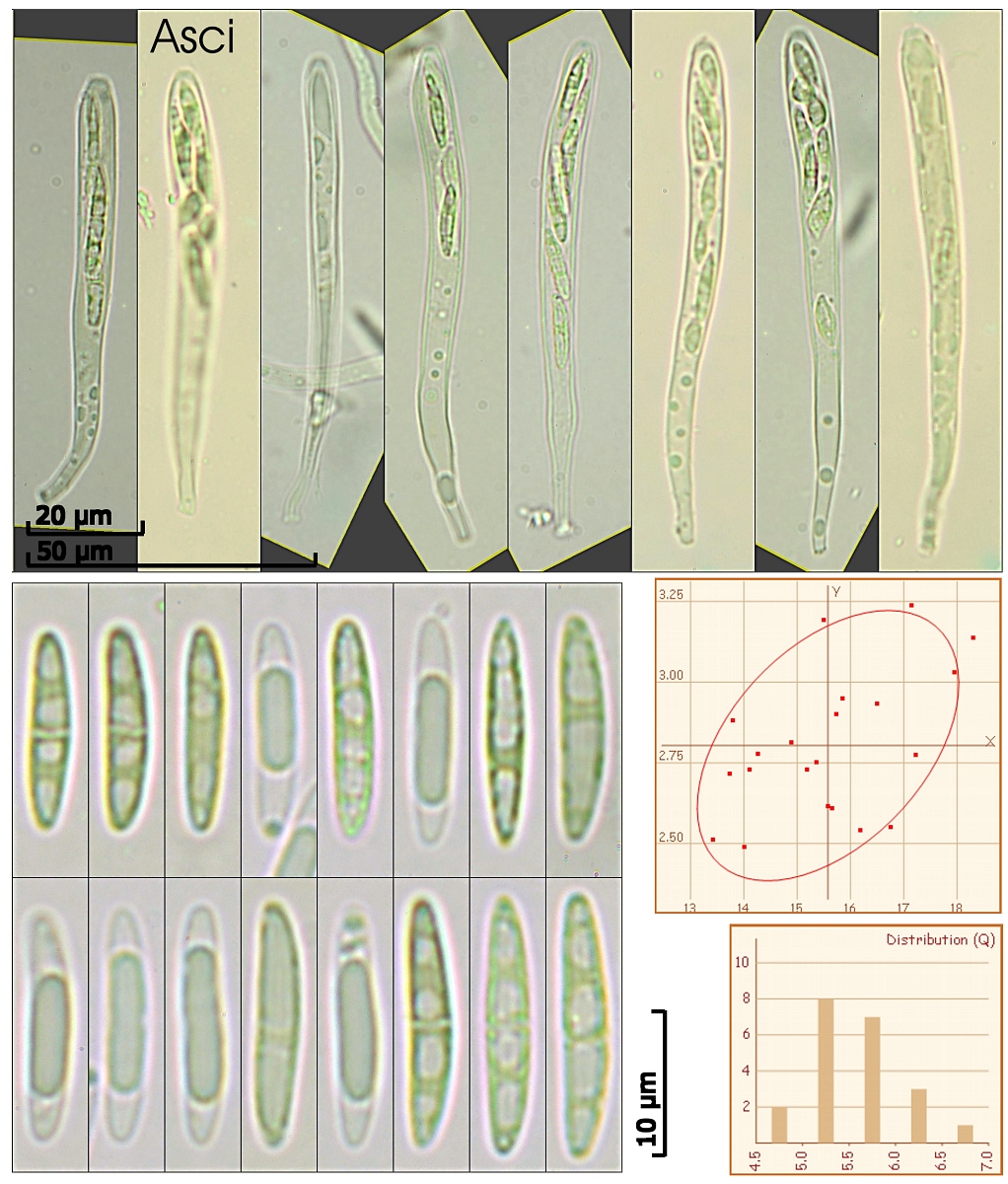
Nach dem Declercq-Schlüssel und vergleich mit Ingo's Beschreibung gelange ich hier zum
Gelben Kräuter-Stielbecherchen (Hymenoscyphus menthae):

[/font]
[font="Arial"]Der nächste Fund war ein richtig schwieriger Fall...
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1049
[/font]
[font="Arial"]Makrodaten:
Fundort: ca. 550 müNN. ca. N50, O12, auf einer im Schlamm liegenden Fichtennadel (er wuchs tatsächlich da dran)
Fundzeit: 25.05.2016
Wuchsform: einzeln
Hutform: Scheibenartig, leicht gewellt
Hut oben: braun, Zentrum dunkler, glatt
Hutrand: dunklere Linie am Hutrand
Stiel: rotbraun, gekörnt, Stiel ist zentrisch angeordnet (sieht auf Bild exzentrisch aus)
Größe: Hutdurchmesser ca. 4 mm, Stiellänge 2 mm, Stieldurchmesser ca. 0,4 mm
Geruch: neutral
Mikrodaten:
Asci:
Porusraktion: blau mit Melzer
80.84 - 92.3 x 5 - 7.47 µm
Q = 11.9 - 18.3 ; N = 5
Me = 88.1 x 6.1 µm ; Qe = 14.8
Paraphysen:
[/font]
[font="Arial"]36.3 - 92.9 x 2.4 - 3.4 µm
Q = 10.6 - 27.9 ; N = 7
Me = 52.7 x 2.8 µm ; Qe = 18.5
[/font]
[font="Arial"]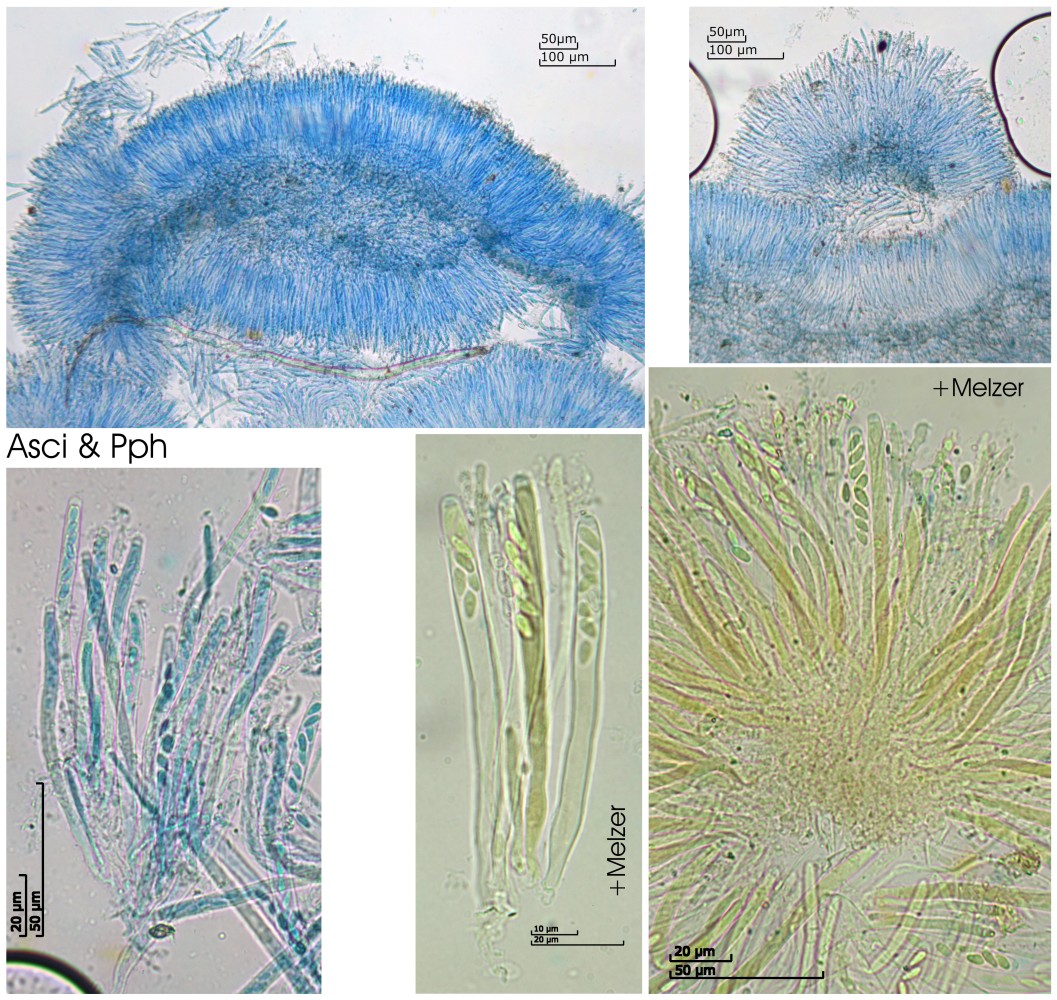
[/font]
[font="Arial"]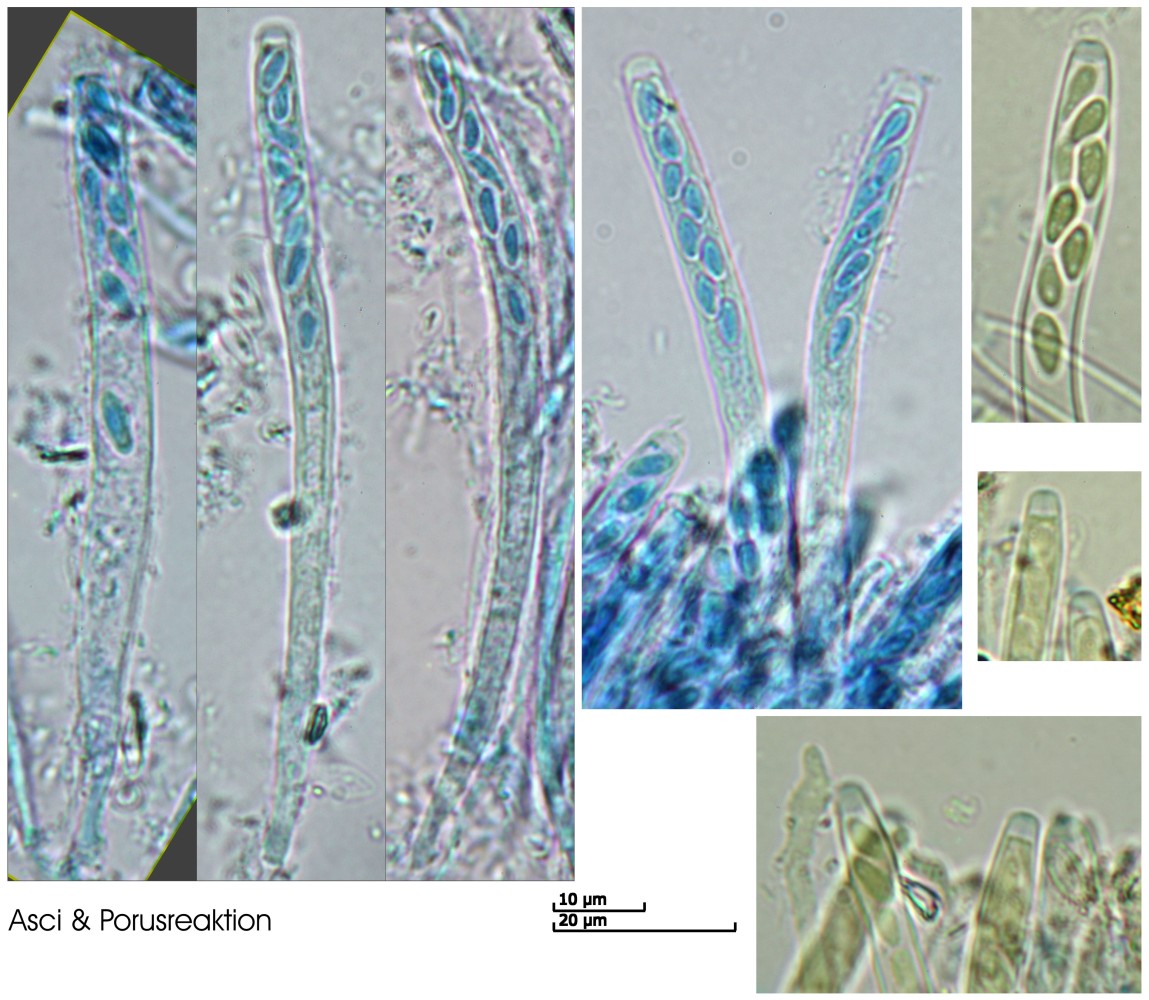
[/font]
[font="Arial"]Sporen:
(5.6) 6.1 - 7.5 (8.6) x (2.8) 2.9 - 3.5 (3.9) µm
Q = (1.7) 1.8 - 2.4 (2.7) ; N = 27
Me = 6.8 x 3.2 µm ; Qe = 2.1
[/font]
[font="Arial"]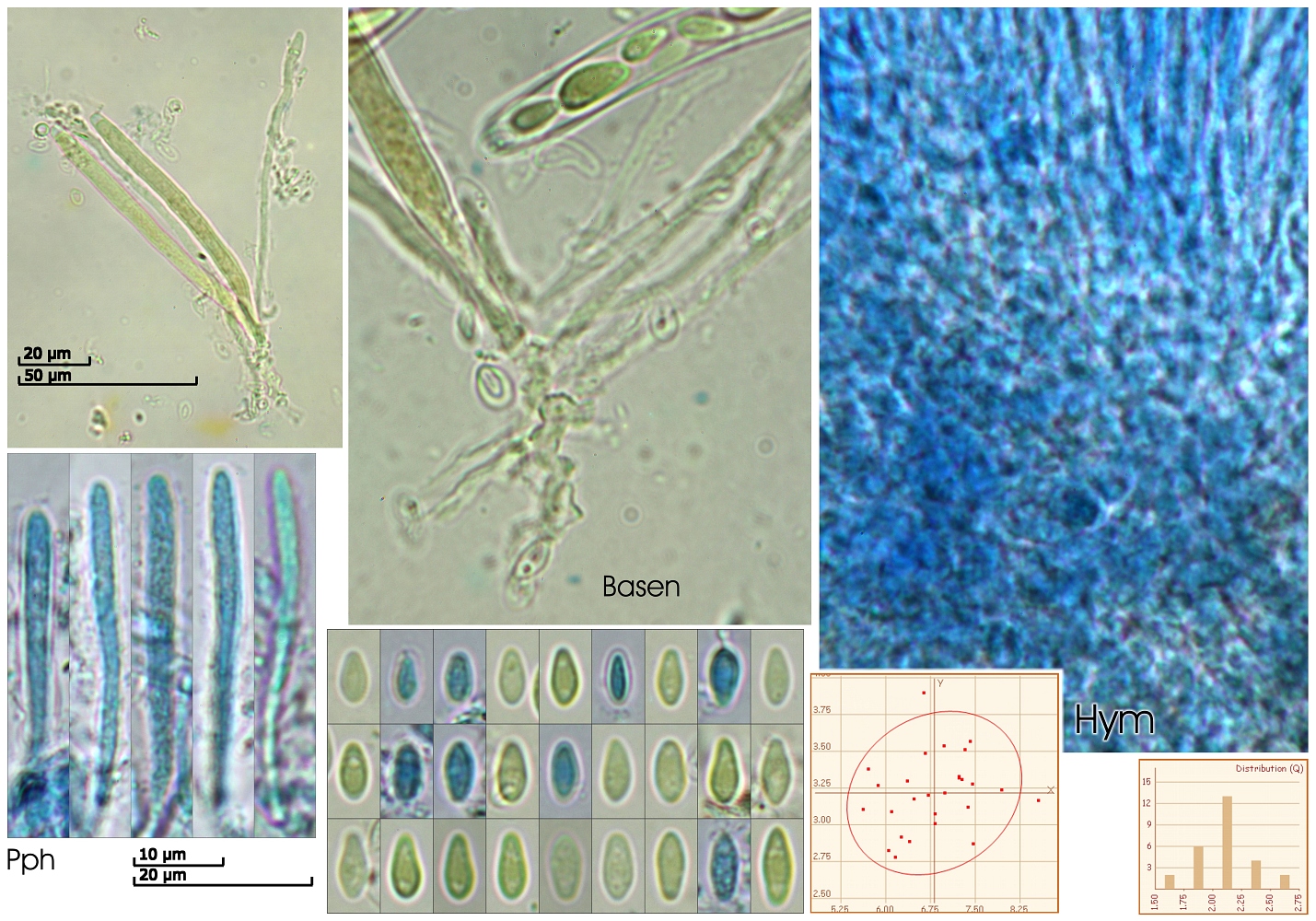
[/font]
[font="Arial"]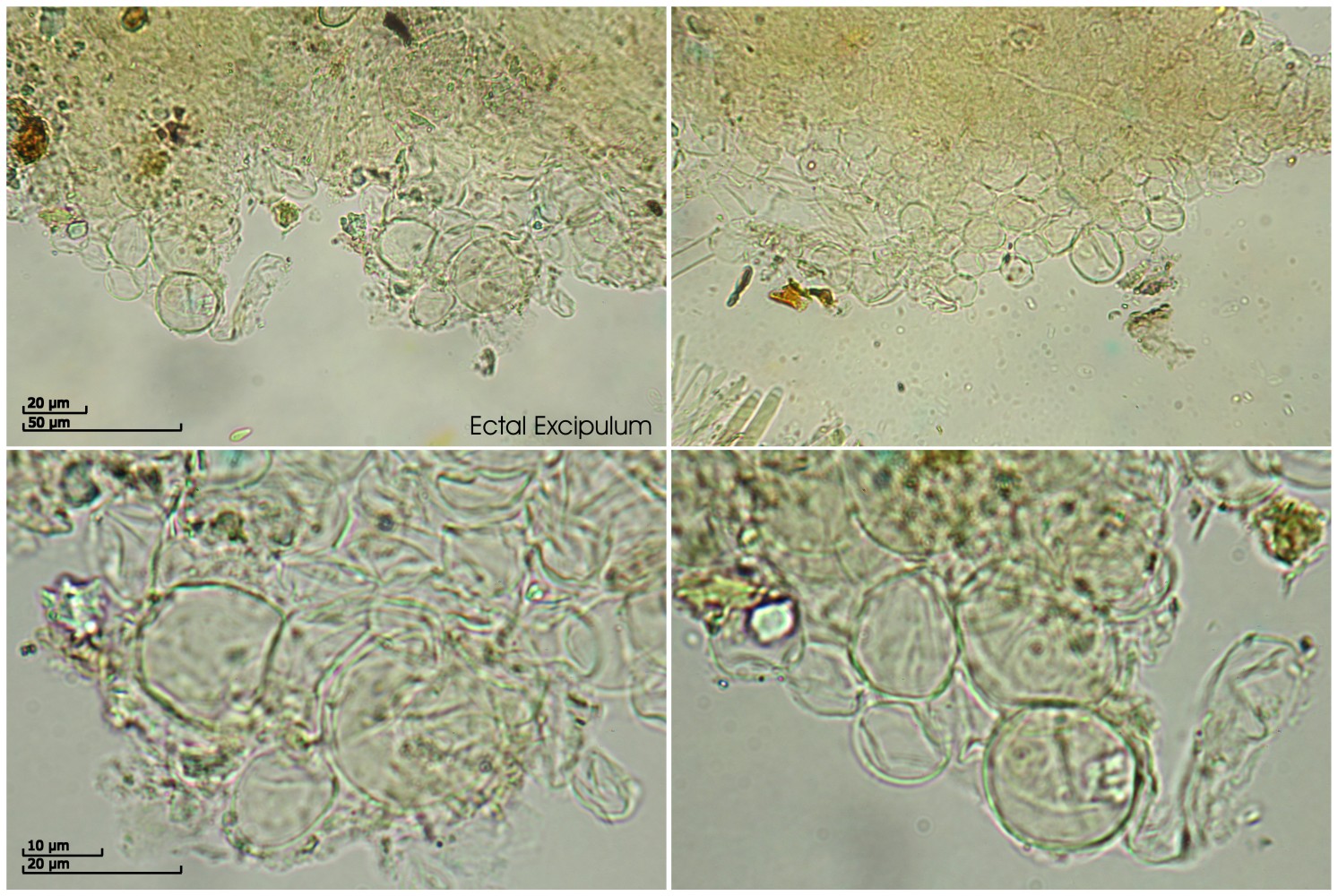
[/font]
[font="Arial"]Hier musst ich Klaus um Hilfe bitten. Er schrieb:
"Der Pilz scheint größtenteils noch unreif zu sein. Ich habe nur sehr wenige frei Sporen finden können, die dann alle mit deinen Maßen übereinstimmten (leicht ciborioid, ohne Inhalt, 6-7 x 3 µm). Die Asci waren noch komplett voll; die wenigen Ausnahmen, die ich gesehen habe, können auch ein Resultat des Quetschen sein. Jedenfalls bleibt die tatsächliche Sporengröße weiterhin rätselhaft. Dass es sich hier um ein Exemplar der Gattung Ciboria handelt, steht für mich weiterhin fest. Nur finde ich absolut nichts, was sich diesen Sporengrößen zuordnen ließe.
Nehmen wir mal diese ominöse Ciboria acicola Kirschstein, die ja vom Substrat her passen würde, von der man aber nicht eine einzige vernünftige Beschreibung finden kann. Insofern muss man sich also auf Kirschsteins Typusbeschreibung und die dort angegeben Sporengröße von 8-10 x 3-4 µm verlassen. Sollte es sich hierbei um tote Sporen handeln, wäre der aktuelle Fund raus. Hat er vital gemessen, wäre es zumindest möglich, dass die Sporen reif deutlich länger und breiter wären. Aber der Konjunktiv nutzt einem natürlich nichts. Und weiter reifen wird der Fruchtkörper ja jetzt auch nicht mehr. Am besten: Nochmal finden;-)"
Es bleibt also ein unsicherer Kiefernnadel-Stromabecherling (Ciboria cf. acicola):

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Dann ein Helmling, den ich zu diesem Zeitpunkt noch nicht so recht kannte...
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1055
Fundort: ca. 550 müNN. ca. N50, O12, an einem Stück vermutlich Rinde im feuchten Moos
Fundzeit: 25.05.2016
Wuchsform: paarweise
Hutform: konvex, leichter Buckel
Huthaut: grau, nach außen hin heller werdend, Lamellen durchscheinend, glatt, glänzend
Hygrophanität: nicht festegestellt
Hutrand: jung kantig, alt ausgefranst
Lamellen: weiß, bogenförmig, mit Zwischenlamellen, weit entfernt stehend
Lamellenschneiden: bewimpert
Lamellen - Stielübergang: gerade angewachsen, leicht herablaufend
Stiel: weiß, bereift auf ganzer Länge
Stielbasis: ohne Besonderheiten
Fleisch: ohne Besonderheiten
Größe: Hutdurchmesser ca. 0,2 cm, Stiellänge 2 cm, Stieldurchmesser ca. 0,4 mm
Sporenpulverfarbe: nicht getestet
Geruch: nicht wahrnehmbar
Geschmack: nicht probiert
[/font]
[font="Arial"]Matthias half schnell - das ist der Bogenblättrige Helmling (Mycena speirea):

[/font]
[font="Arial"]
[/font]
[font="Arial"]Der nächste war hübsch, deshalb hab ich den auch mal fotografiert.
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1236
[/font]
[font="Arial"]Geruch: stark pilzig und leicht fruchtig
[/font]
[font="Arial"]Der ganz normale Violette Rötelritterling (Lepista nuda):

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1321
[/font]
[font="Arial"]Ein Tintling...
Stielbereifung: ja
Sporenpulverfarbe: schwarz
[/font]
[font="Arial"]Mikrodaten:
[/font]
[font="Arial"]Kaulozystiden:
[/font]
[font="Arial"]keine vorhanden[/font]
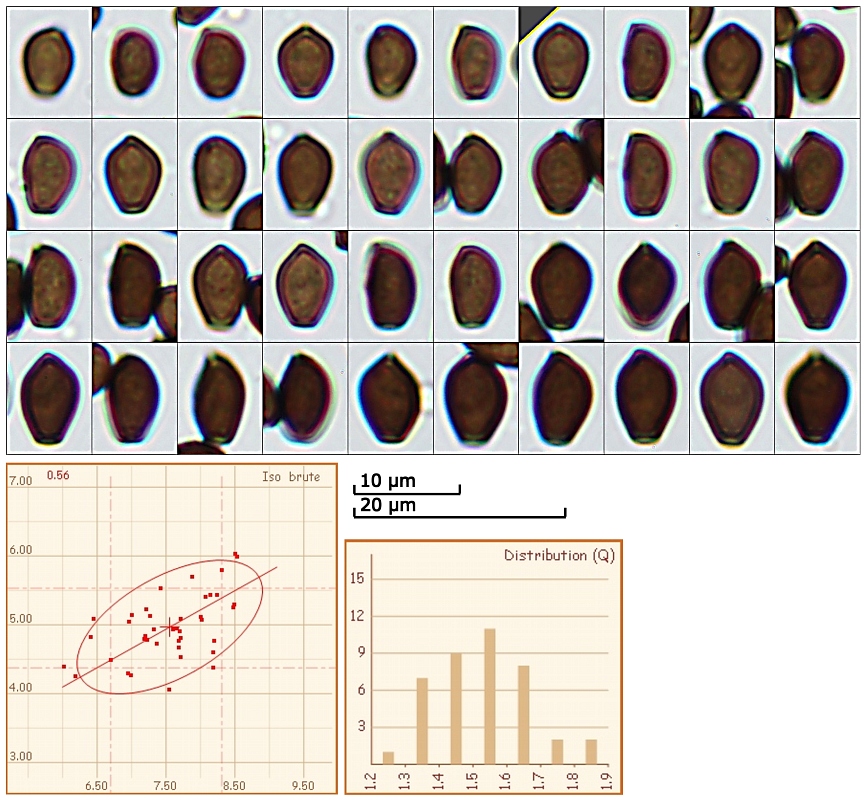
[font="Arial"]Sporen:
mitraförmig
(6) 6.7 - 8.3 (8.5) x (4.1) 4.4 - 5.5 (6) µm
Q = (1.3) 1.4 - 1.7 (1.9) ; N = 40
V = (59) 67 - 127 (162) µm ³
Me = 7.6 x 5 µm ; Qe = 1.5 ; Ve = 99 µm ³
[/font]
[font="Arial"]Mit dem Unterscheidungsmerkmal "mitraförmige Sporen in der Überzahl" um saccharinus von micaceus zu unterscheiden komme ich nicht klar, denn der Übergang von mitraförmig auf nicht mitraförmig ist schwimmend. Eine Abgrenzung wann eine Spore noch mitraförmig ist und wann nicht, quasi gar nicht möglich. Somit verwende ich dieses Unterscheidungsmerkmal nicht.
Ich verwende in der Regel den Schlüssel von Matthias den er mir immer wieder sagen muss weil ich ihn jedes mal auf's neue vergesse  - gell:
- gell:
1 Sporen nicht mitraförmig -> truncatus
1* Sporen mitraförmig -> 2
2 Kaulos vorhanden -> micaceus
2* Kaulos nicht vorhanden -> saccharinus
Das ist der Überzuckerte Tintling (Coprinellus saccharinus):

[/font]
[font="Arial"]
[/font]
[font="Arial"]Der nächste war ein optischer Leckerbissen...
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1339
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, direkt an Nadelholzstumpf (wahrscheinlich Fichte)
Fundzeit: 25.05.2016
Wuchsform: gesellig, teilweise fast büschelig
Hutform: jung stumpfkegelig, dann aufschirmend, dann nach oben gebogen mit Buckel
Huthaut: Zentrum olivgrün, alt bräunlich und auch blau, nach außen hin heller werdend, Lamellen durchscheinend
[/font]
[font="Arial"]Hygrophanität: nicht festgestellt
Hutrand: im Alter hellblau bis blauschwarz
Lamellen: weiß, mit Zwischenlamellen
Lamellenschneiden: beflockt
Lamellen - Hutübergang: frei bis angeheftet
Stiel: grau bis braun, stark bereift, Spitze rinnig bereift, hohl
Stielbasis: wurzelnd, myzelfilzig
[/font]
[font="Arial"]Fleisch: ohne Besonderheiten
Größe: Hutdurchmesser ca. 5-12 mm, Stiellänge ca. 4-7 cm, Stieldurchmesser ca. 1 mm
Sporenpulverfarbe: nicht getestet
Geruch: nitrös
Geschmack: nicht probiert
[/font]
[font="Arial"]Der Geschmückte Helming (Mycena amicta)...
Schaut Euch diese Blautöne an!

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Schaut Euch den blauen Hutrand an:

[/font]
[font="Arial"]Dieser war richtig schön blau:

[/font]
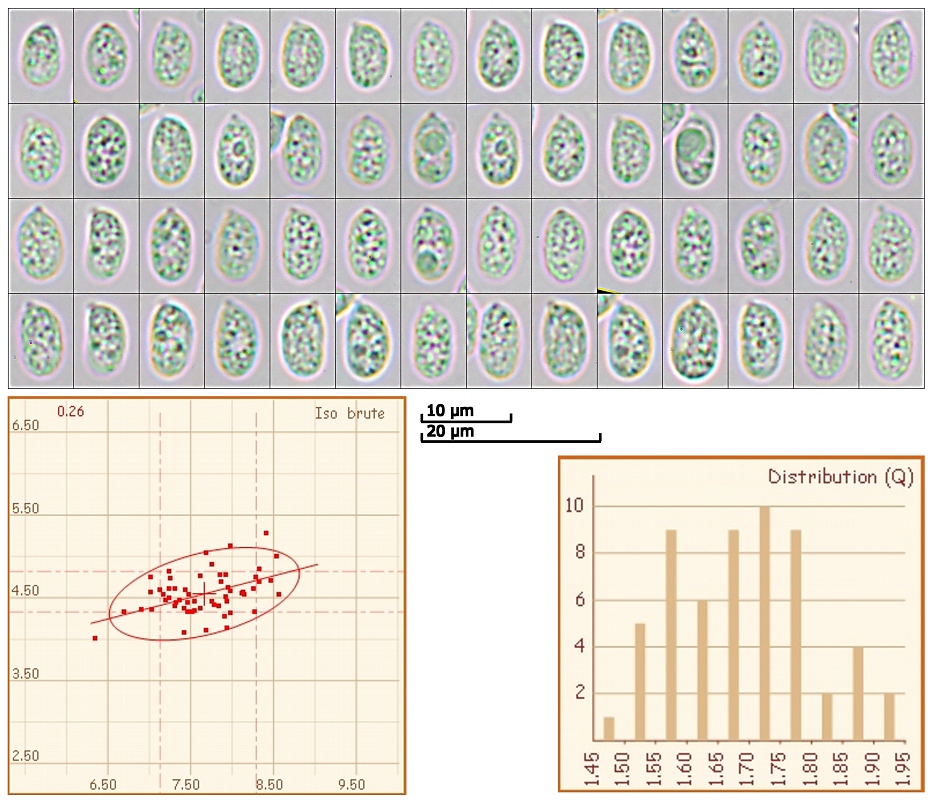
[font="Arial"]Zum Spaß nahm ich mal die Sporen auf:
[/font]
[font="Arial"](6.3) 7.1 - 8.3 (8.6) x (4) 4.3 - 4.8 (5.3) µm
Q = (1.5) 1.55 - 1.8 (1.9) ; N = 57
V = (53) 71 - 98 (123) µm ³
Me = 7.7 x 4.5 µm ; Qe = 1.7 ; Ve = 83 µm ³
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1401
[/font]
[font="Arial"]Auch hübsch - die Hasenpfote (Coprinopsis lagopus):

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1406
[/font]
[font="Arial"]Am gleichen Standort wie 2015 - der Blassstielige Dachpilz (Pluteus satur):

[/font]
[font="Arial"]Fundnummer: 2016-05-25-1413
[/font]
[font="Arial"]Makrodaten:
Fundort: ca. 550 müNN. ca. N50, O12, an unbekanntem sehr durchfeuchtetem Totholz auf Grünabfallhaufen im Wald
Fundzeit: 25.05.2016
Wuchsform: gesellig
Scheibenfarbe: orange
Borstenfarbe: dunkelbraun
Größe: Durchmesser 3-4 mm
[/font]
[font="Arial"]Mikrodaten:
Haare:
Wurzeln verzweigt
314.8 - 1101.06 x (26.6) 26.64 - 35 µm
Q = (11.8) 11.82 - 32.08 (32.1) ; N = 5
Me = 556.5 x 32.2 µm ; Qe = 17
[/font]
[font="Arial"]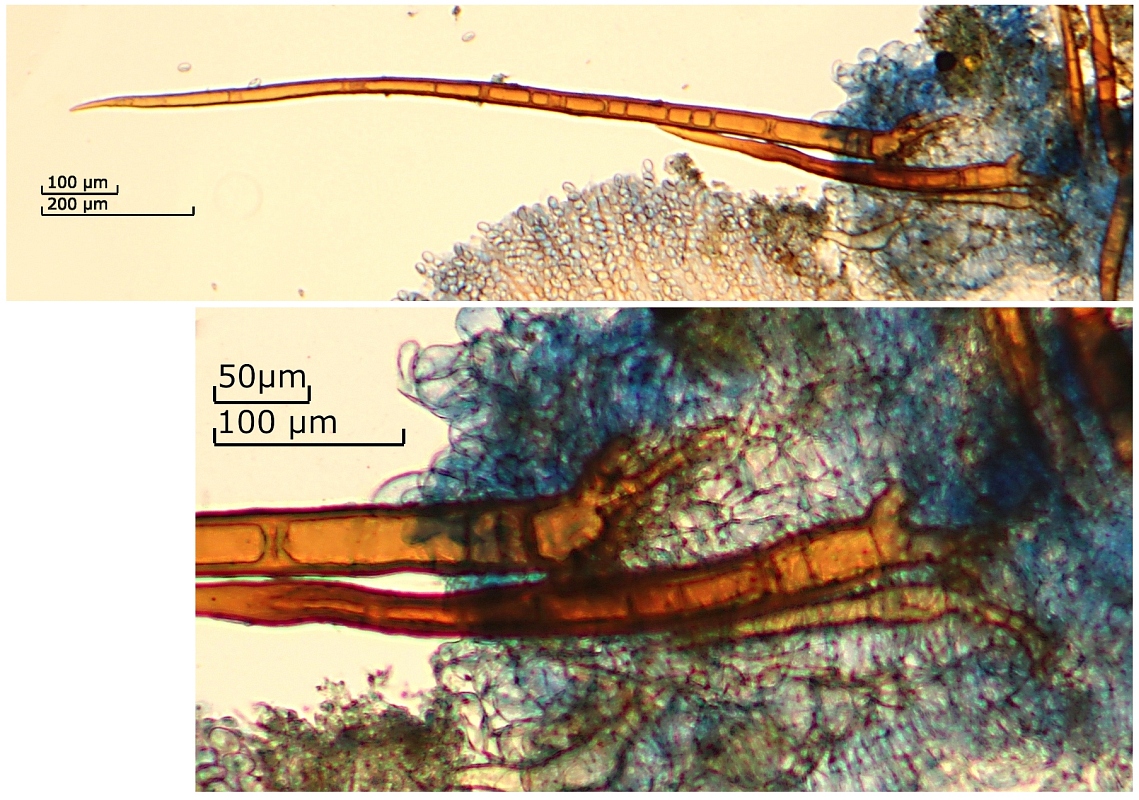
[/font]
[font="Arial"]Asci:
8-sporig
(16.7) 17.5 - 21 (21.7) µm
N = 14
Me = 19.1 µm
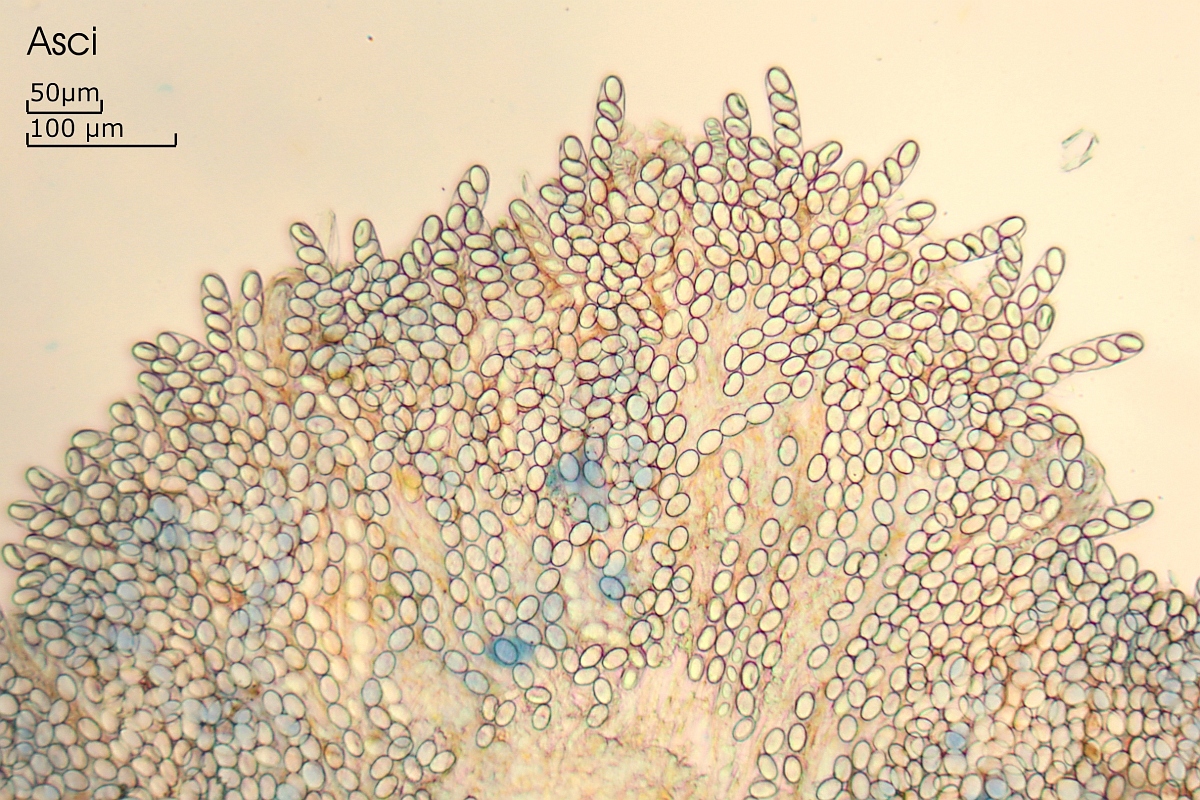
[/font]
[font="Arial"]Sporen:
leider noch unreif, aber wohl punktiert gewarzt.
Keine freien Sporen gefunden –“ deshalb Messung der Sporen in den Asci:
(17.8) 18.3 - 19.8 (20.4) x (10.6) 10.9 - 12.4 (13) µm
Q = (1.5) 1.55 - 1.75 (1.8) ; N = 20
V = (1079) 1178 - 1568 (1794) µm ³
Me = 19 x 11.8 µm ; Qe = 1.6 ; Ve = 1393 µm ³
[/font]
[font="Arial"]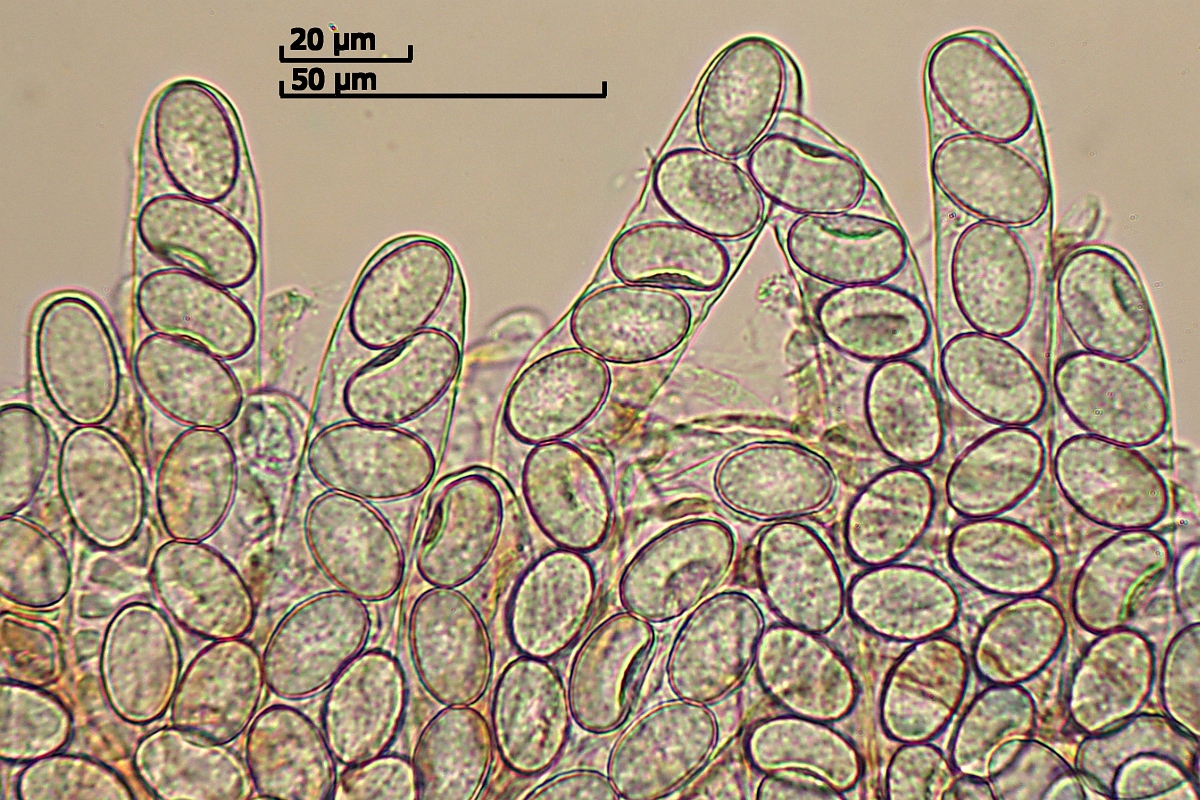
[/font]
[font="Arial"]Das ist der Bewimperte Schildborstling (Scutellinia crinita):

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Und kurz vor Ende noch ein hübscher Standard:
[/font]
[font="Arial"]Fundnummer: 2016-05-25-1510
[/font]
[font="Arial"]Ein Ohrlöffelstacheling (Auriscalpium vulgare):

[/font]
[font="Arial"]
[/font]
[font="Arial"]Den Abschluss macht heute...
Fundnummer: 2016-05-25-1522
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, im Sphagnum im sumpfartigen Gelände
Fundzeit: 25.05.2016
Wuchsform: gesellig
Hutform: abgeflacht, mit deutlichem zitzen-artigem Buckel
[/font]
[font="Arial"]Huthaut: braun, nach außen hin heller werdend, glatt, Lamellen durchscheinend
Hutrand: alt nach oben gebogen
Hygrophanität: nicht getestet
Lamellen: creme, mit Zwischenlamellen, mit Y-Gabeln, queradrig verbunden
Lamellenschneiden: ohne Besonderheiten
Lamellen-Stielübergang: frei, aber auch ausgebuchtet angewachsen und herablaufend
Fleisch: brüchig
Stiel: grau, unten dunkelbraun, hohl, glatt, sehr zerbrechlich
[/font]
[font="Arial"]Stielbasis: normal
Größe: Hutdurchmesser 1-1,3 cm, Stiellänge 5-7 cm, Stieldurchmesser ca. 1,5 mm
Sporenpulverfarbe: weiß
Geruch: stark mehlig
[/font]
[font="Arial"]Geschmack: nicht probiert
[/font]
[font="Arial"]Das Sumpf-Graublatt (Sphagnurus paluster):

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Sporendaten:
fein gewarzt
(5.9) 6.1 - 7.6 (8.7) x (3.5) 3.8 - 4.4 (4.8) µm
Q = (1.4) 1.5 - 1.9 (2) ; N = 54
V = (39) 48 - 75 (106) µm ³
Me = 6.9 x 4.1 µm ; Qe = 1.7 ; Ve = 62 µm ³
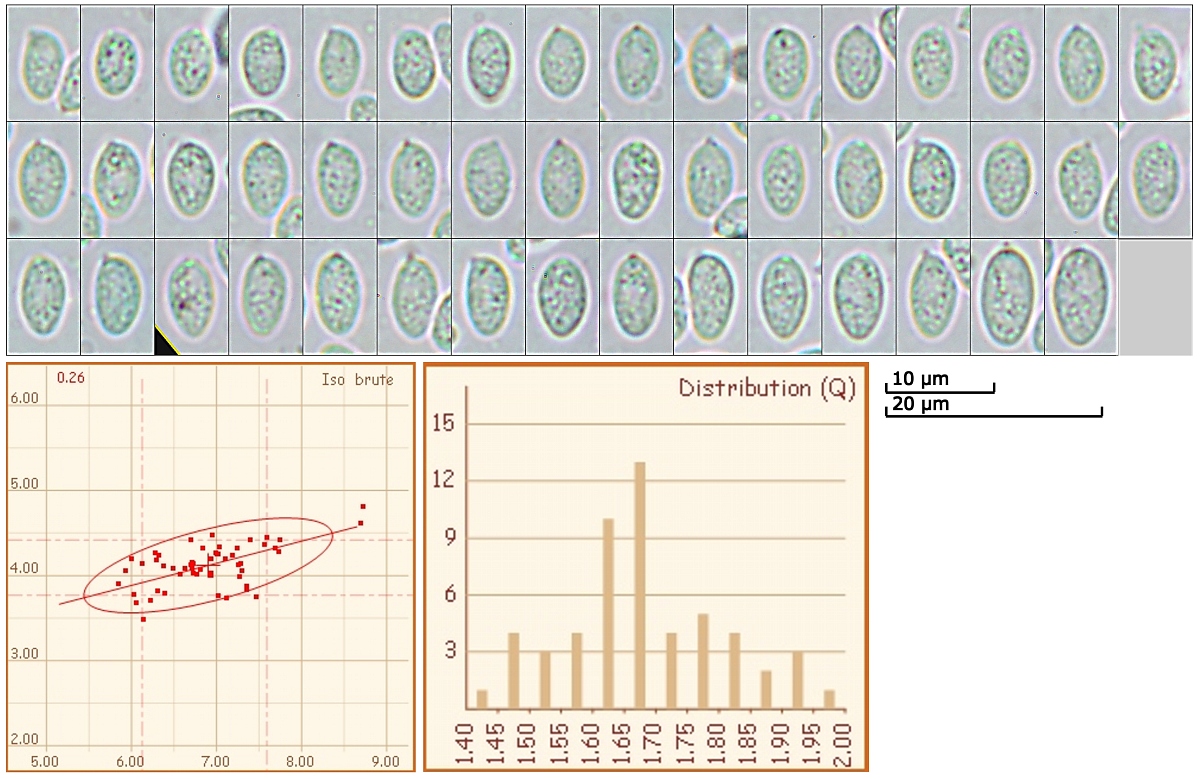
[/font]
[font="Arial"]Das war's für heute....
Bis bald
Dieter
[/font]


