Hallihallo,
am 11.Jan. 2015 waren Ralf und ich mal wieder im Bergischen unterwegs (Grube Cox bei Bergisch Gladbach) und haben so allerlei Kleinzeugs eingesammelt, darunter auch Äste, Holzstücke und Stängel aus dem Wasser (Uferzone, angeschwemmt). Bis jetzt, mit 3 Tage Unterbrechung aufgrund Sphondylolisthesisesis oder wie der sch... heißt, habe ich etwa 1/100 des Materials durch. So jedenfalls scheint es, denn wir haben die meisten der jetzt im 1. Teil gezeigten Arten im Feld überhaupt nicht gesehen. Es scheint sogar so, dass noch Arten in vitro nachwachsen 
Naja ich stelle die Arten in gewohnter Manier mit einigen Kommentaren vor und hoffe, ihr habt Spaß beim Angucken.
Bingsheng (2000) hat von dieser Gattung eine ganz passable Monographie geschrieben, die im Internet leider nur bruchstückhaft als PDF zu erhalten ist (es fehlen viele Seiten, darunter auch eine Schlüsselseite). Darin sind 2 Arten erwähnt, nämlich A. elasticae und A. applanata mit ähnlichen Sporenmaßen und zudem vorhandenen Polkappen (die sind in Anthostomella nicht häufig). Hinzu kommt das Substrat (Phragmites), also habe ich hier mal schnell die Substratliste genommen und nachgeguckt: A. cyperaceicola, A. punctulata und A. tomicoides wurden in Europa bisher von Phragmites gemeldet. Alle 3 scheiden aufgrund fehlener Polkappen und z.T. erheblich unterschiedlicher Sporengröße aus. Ich vermute, dass die von uns gefundene Art durchaus bekannt ist, bisher aber nicht mit dem Merkmal "Polkappen" beschrieben wurde (evtl. übersehen). Ich habe sie übrigens auch erst nicht bemerkt, erst bei genauem Hingucken und dann nach Einfärbung in Kresylblau wurden sie dann deutlich.



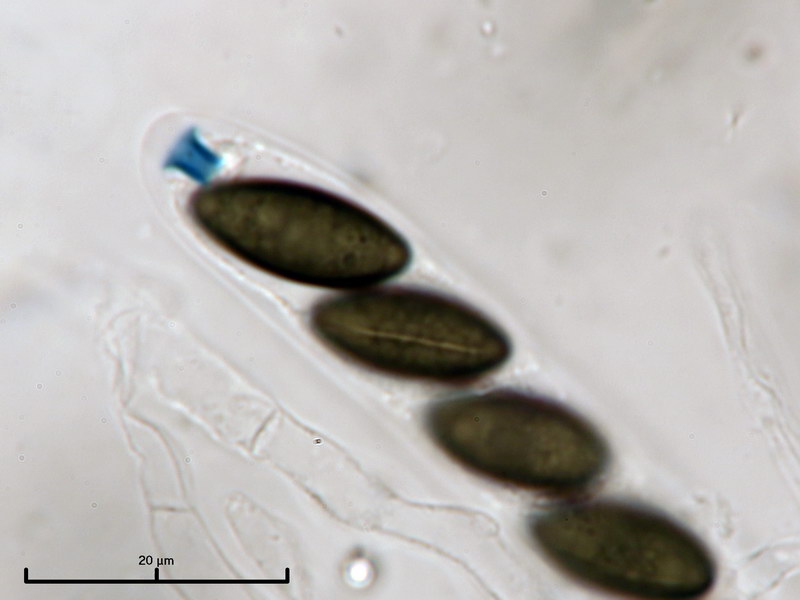
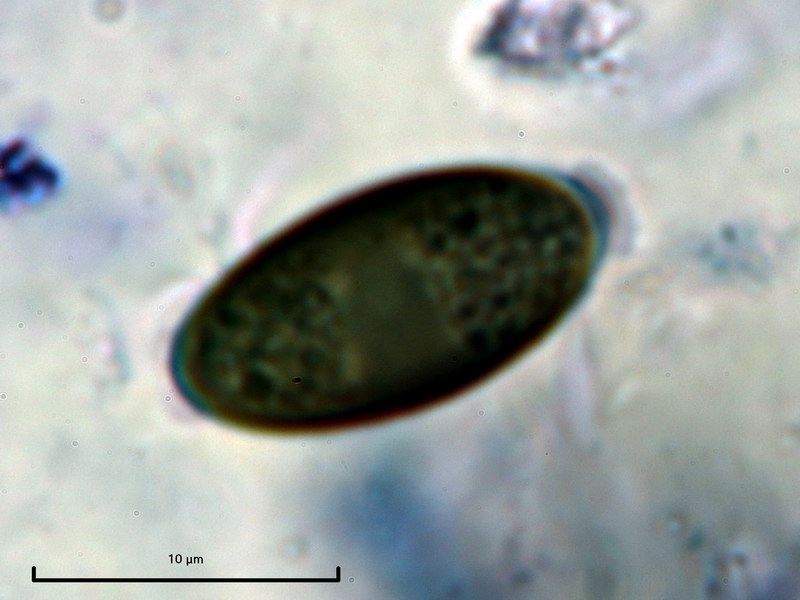
Mit der Bestimmung dieser Art gab es dagegen keine Probleme, sie ist im BL schon einmal aufgetaucht und auf untergetauchtem Holz wohl nicht selten. Erstmalig kann ich ein Bild der Oberflächenstruktur präsentieren, welche deutlich gestreift ist.

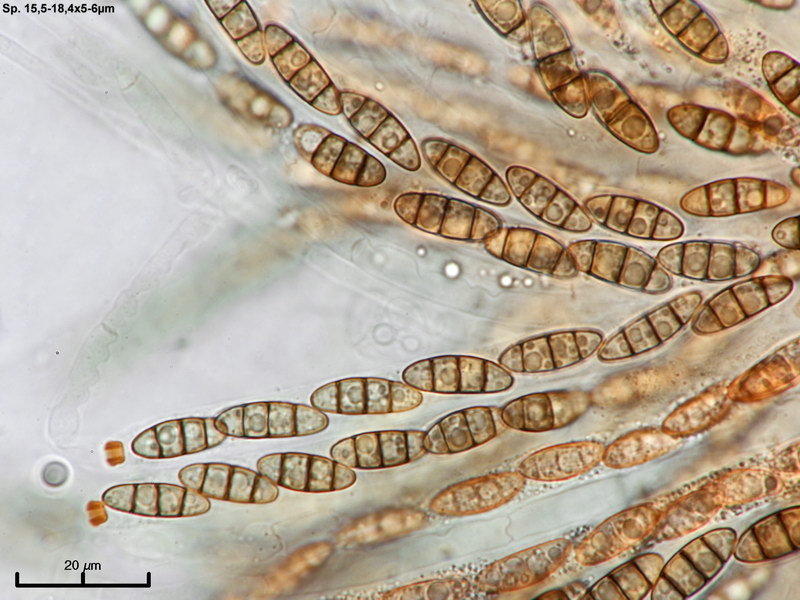
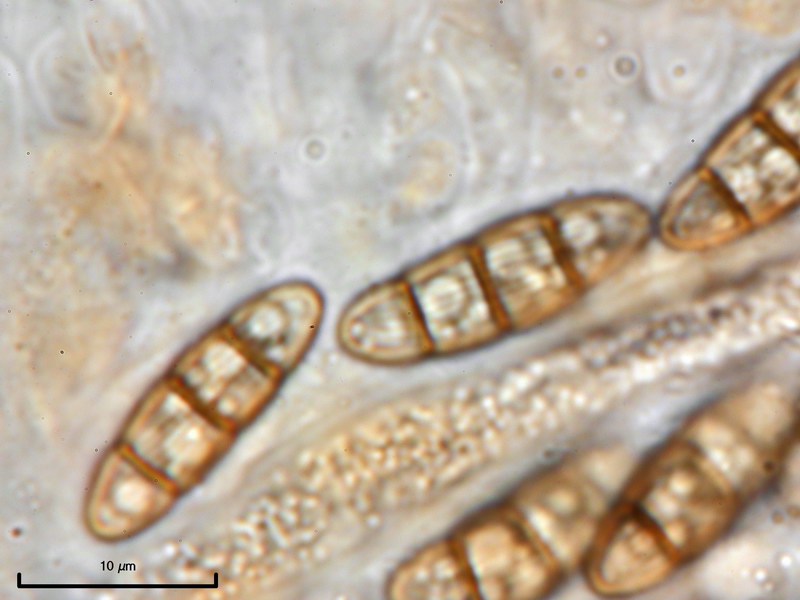

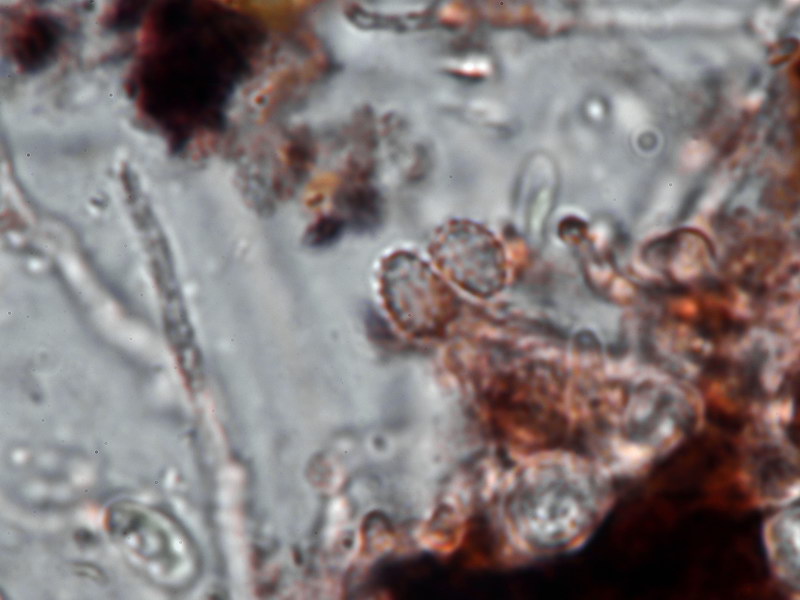
Capronia sp. 'macrospora' (E00427)
Diese Kollektion ist identisch mit einer von Eike gefundenen Kollektion aus Hannover. Eine Capronia mit derart großen Sporen (z.T. >20 µm Länge) ist bisher nicht bekannt.


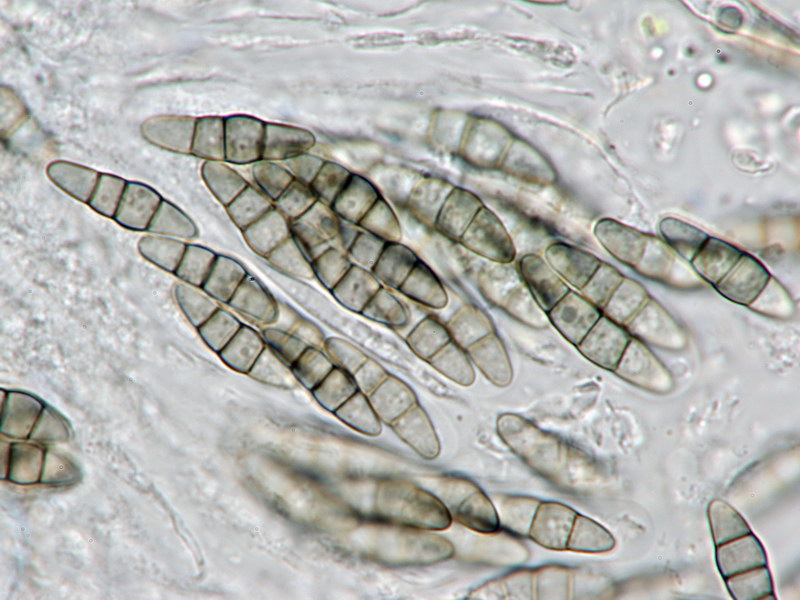
Diese Art ist neu für NRW. Die Checkliste enthält keinerlei Funde von der Xylariales-Verwandte mit den bis 1mm großen, kugeligen Perithezien, die vollständig auf der Oberfläche sitzen und vergleichsweise weich sind (keineswegs kohlig-hart wie Hypoxylon). Typisch sind zudem die eher kleinen Sporen (die in dieser Kollektion auffallend krumm sind, was nach J. Fournier 'pyrenomycetes.free' aber vorkommen kann) sowie die KOH-Reaktion der Perithezienwand (intensiv orangerot). In dieser Wand soll eine orangefarbene Schicht eingelagert sein, die bei der Kollektion allerdings eher olivgrünlich war. Die Gattung Creosphaeria ist in Europa meines Wissens nur noch durch 2 andere Arten vertreten (C. verruculosa und C. pinea).

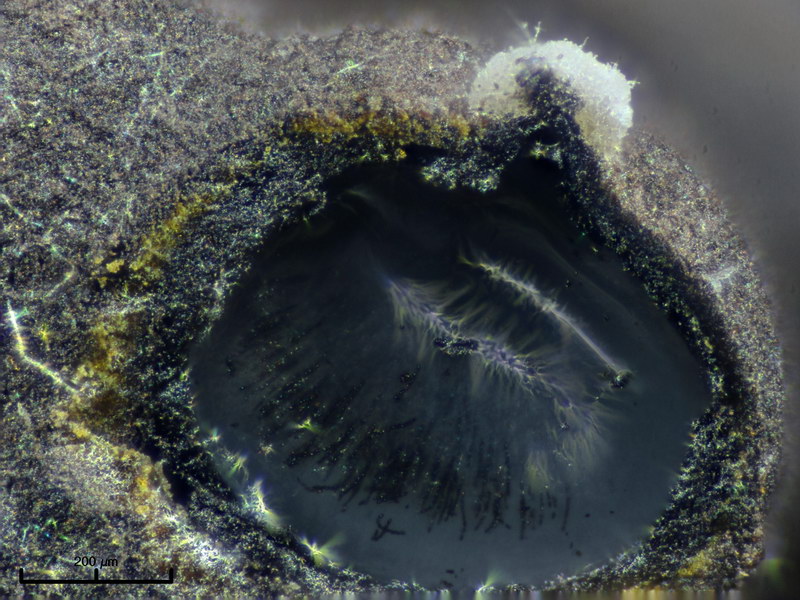

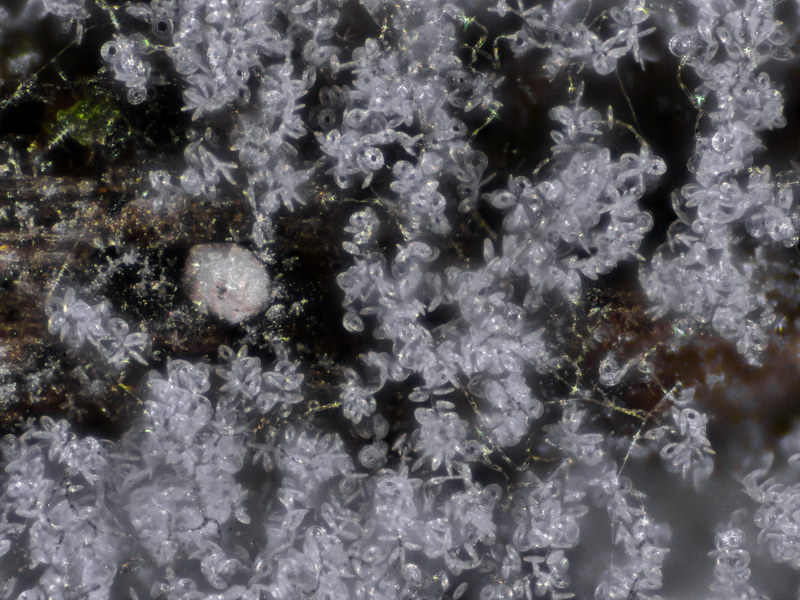
Helicosporium sp. (Hyphomycet, Anamorphe von Tubeufia sp.)
Dieser interessante Hyphomycet fand ich auf einem untergetauchten Holzstück, und zwar von der gleichen Stelle, wo wir auch Ascitendus gefunden hatten. Hyphomyceten sind als Nebenfruchtformen von zumeist Schlauchpilzen nahezu überall zu finden, meistens allerdings erst unter der Stereolupe erkennbar, d.h. man sammelt draußen wahllos Substrate ein und hat irgendwo dann welche dabei. Oder sie entstehen und entwickeln sich in vitro in einer Dose, was ziemlich gut klappt. Arten mit helicoiden, also spiralförmigen Sporen gibt es nur wenige, allerdings ist die Gattung Helicosporium recht unübersichtlich. Daher bleibt es erstmal bei sp.
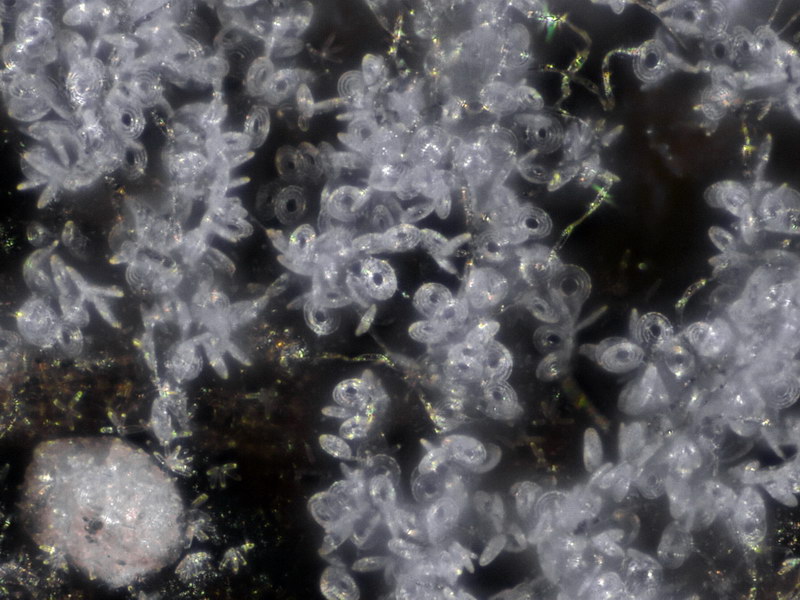


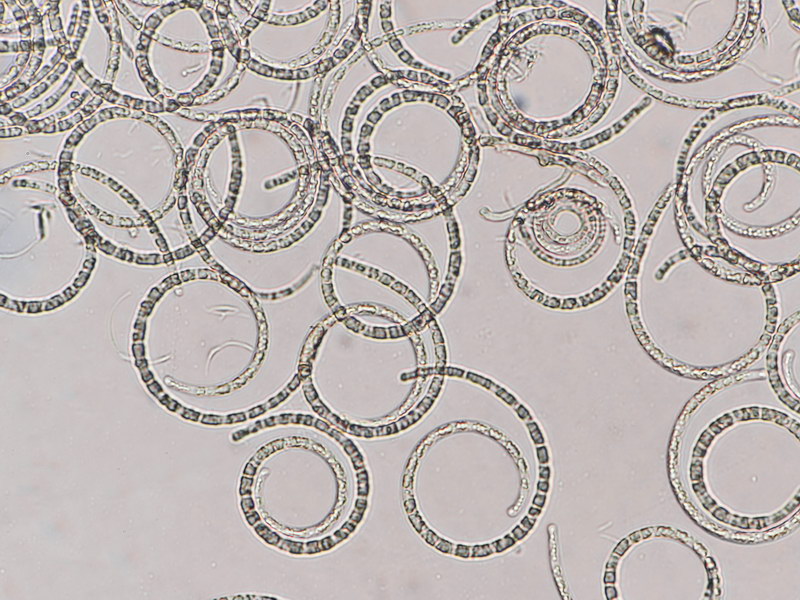
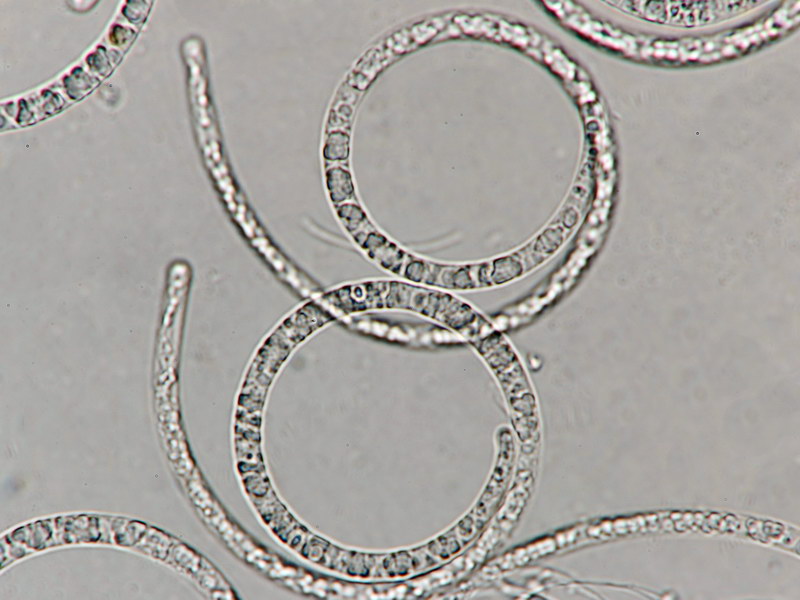
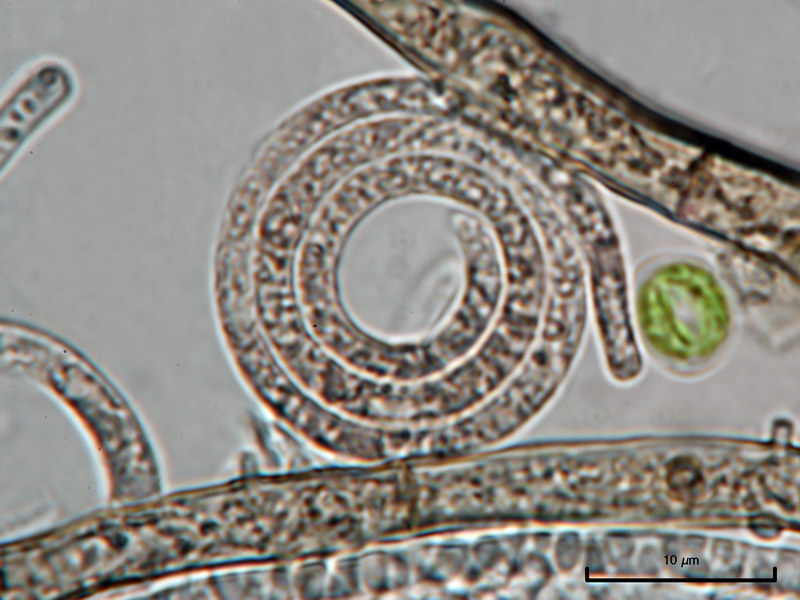
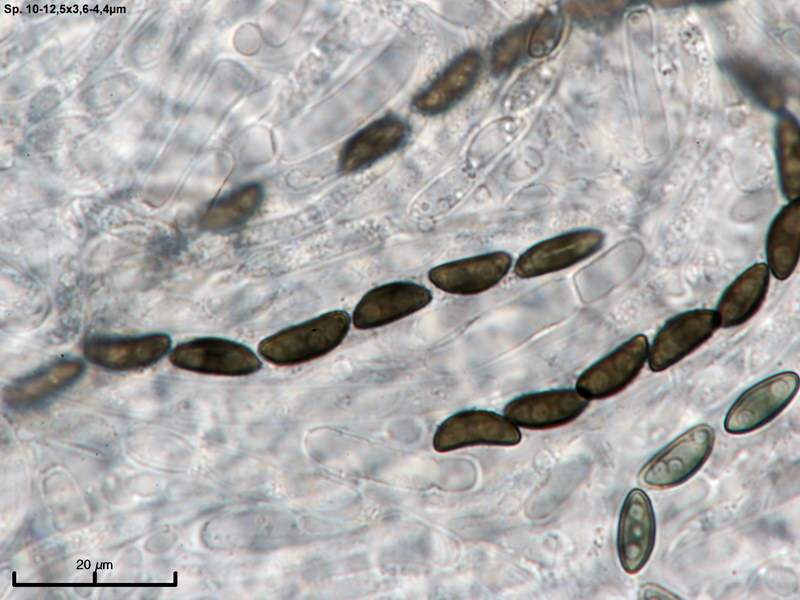
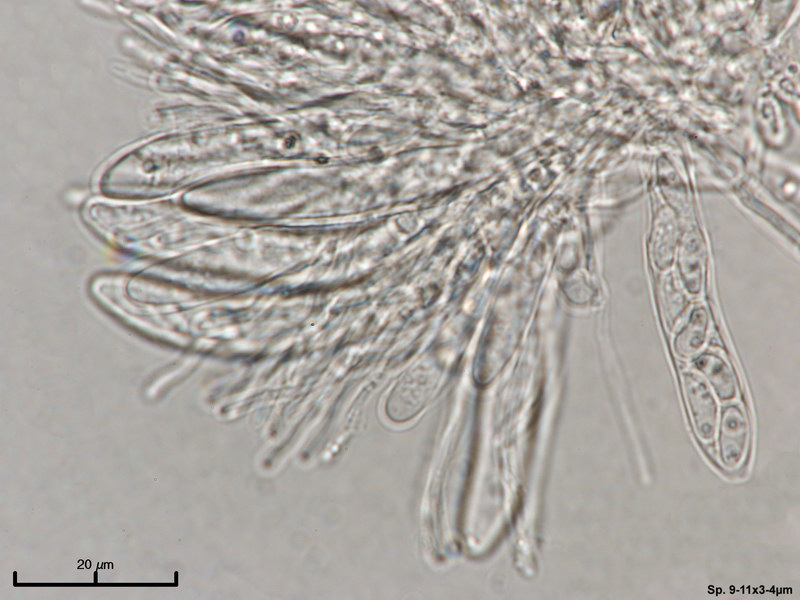
Hyaloscypha albohyalina var. spiralis
Typisch für diese Art: Vorkommen auf Laubholz, Asci ohne Haken und entsprechende Sporengrößen um 9-11x3-4 µm. Sie gehört zu den Arten, die an oder zwischen den Randhaaren keine harzartigen Ablagerungen hat (wie z.B. bei Hyaloscypha aureliella).



[hr]
X. tulasnelloideum (Syn.: Xenasmatella tulasnelloidea) ist zwar schon in der Checkliste aufgeführt, aber sicher nicht häufig berichtet, denn der form- und farblose Überzug besteht praktisch nur aus dünnen Hyphen und einzelnen, vorstehenden Pleurobasidien. Das sind Basidien, die seitlich gewachsen sind, also z.B. eine Art "Sporn" an der Seite haben und dann rechtwinklig davon weg wachsen. Auf einem der Bilder habe ich dieses Merkmal festhalten können. Ebenso auch die von BK (Band 2) nicht bemerkten Septen, die auch Schnallen aufweisen. Pleurobasidiale Rindenpilze hatten wir im Bergischen Land schon einige Male (Amyloxenasma).




To be continued...


