Willkommen in Teil 6 der Forumsreihe „QGIS für Pilzfreunde“!
Hier die Übersicht über alle Teile dieser Forumsreihe
Für Teil 7 ist geplant: gpx-Import von Tracks, Routen und Pilzfunden von einem GPS-Empfänger.
Ziel für heute: Das Shape des Biotops aus Teil 5 in QGIS importieren, bearbeiten und als kml-Datei exportieren:
A) Umstellen des Projekt-KBS auf ETRS89/UTM32N (EPSG:25832)
B) Umbenennen des Shapes und Import des Shapes als Vektorlayer
C) Darstellung der Layer-Objekte ändern
D) Export des Layers als kml-Datei
E) kml-Import in GPS-Software
Fangen wir also an:
A) Umstellen des Projekt-KBS auf ETRS89 / UTM Zone 32N EPSG:25832
Da wir später in QGIS Strecken und Flächen unserer Fundgebiete ausmessen möchten, stellen wir jetzt schon auf ein „flächentreues“ KBS mit karthesischem, metrischem Koordinatensystem um. Und zwar soll hier das inzwischen europaweit gebräuchliche UTM-System eingesetzt werden. Für Deutschland sind die UTM-Zonen 32 und 33 maßgeblich:
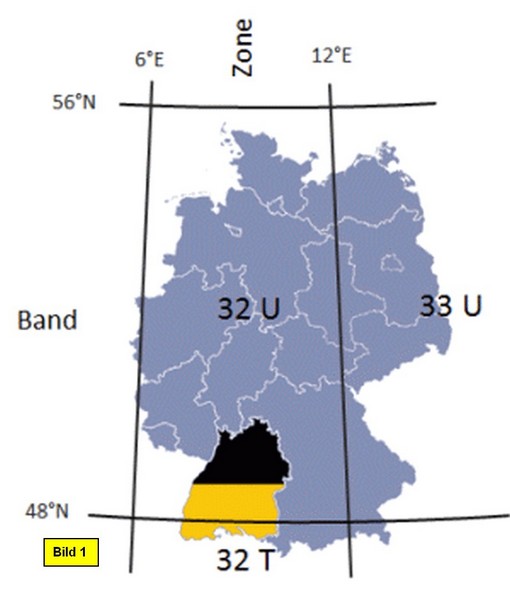
In Baden-Württemberg gilt die UTM-Zone 32N, exakte Bezeichnung ETRS89 / UTM Zone 32N EPSG:25832, worauf wir das Projekt-KBS nun umstellen (wie man das macht, zeigen Teil 2 und Teil 3 dieser Forumsreihe). Anschließend löschen wir noch die WMS-Layer Geologie, indem wir mit der reMT auf den entsprechenden Layer clicken und Layer löschen ausführen.
B) Umbenennen des Shapes und Import des Shapes als Vektorlayer
Hier nochmals das Shape der beiden Biotope in komprimierter Form:
Biotop__Abfrage_.zip
Das zip-File im Bereich unseres Projektes (bei mir \Shapes\Oberer Reutweg\) dekomprimieren. Jetzt noch die fünf Ergebnisfiles und das zip-File in Biotope Oberer Reutweg.* umbenennen. Das Ergebnis sehen wir im Browser-Fenster.
Dort wird von den Einzeldateien des Shapes allerdings nur die shp-Datei angezeigt:
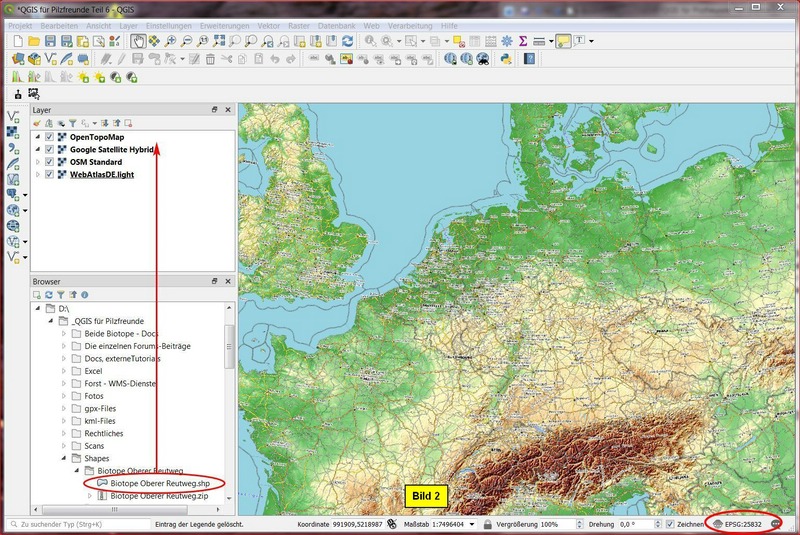
Um das Shape zu importieren, ziehen wir die shp-Datei mit der LiMT ins Layer-Fenster, und zwar als oberstes Layer.
Eine andere Möglichkeit, das Shape zu importieren: Im Menü: Layer > Layer hinzufügen > Vektorlayer hinzufügen ...
In jedem Fall ist das Ergebnis:
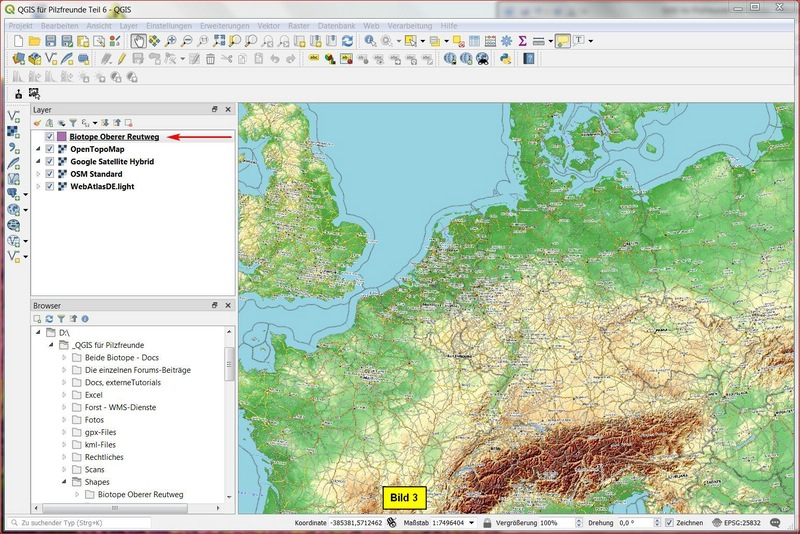
Dann clicken wir mit der ReMT auf diesen Layer und führen die Funktion Auf den Layer zoomen aus und erhalten:

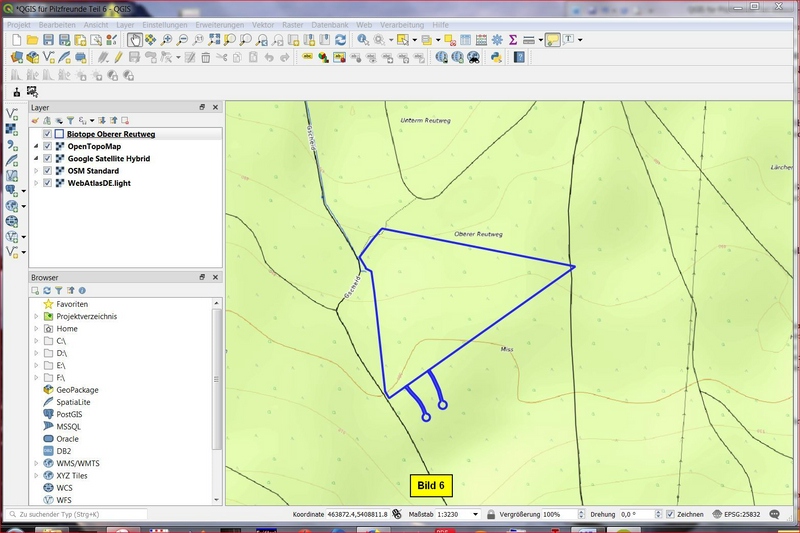
C) Darstellung der Layerobjekte ändern
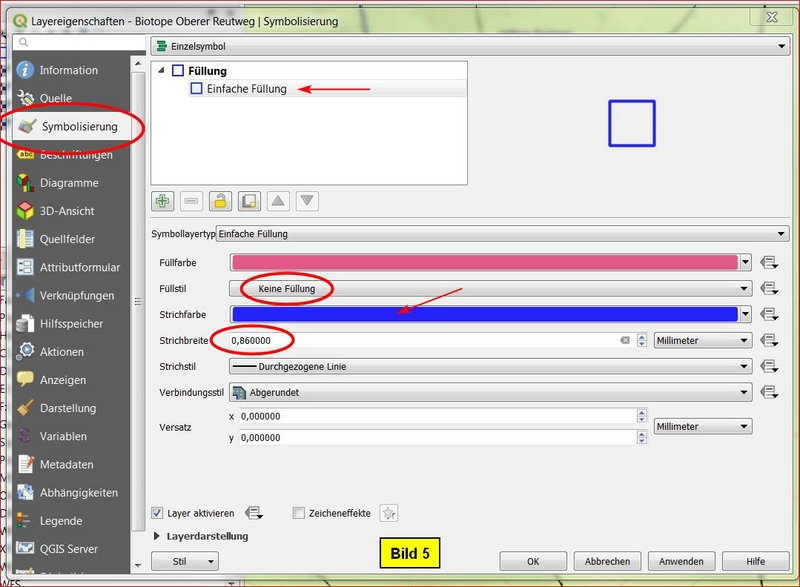
Erst einmal die Objekte etwas kleiner darstellen. Dann im Layerfenster mit ReMT auf den Layer clicken, Eigenschaften anzeigen lassen und hier auf Symbolisierung > Füllung > Einfache Füllung gehen und beispielsweise wie folgt parametrieren:
Füllstil: keine Füllung; Strichfarbe: blau; Strichbreite: etwa 0,86 mm.
Dann noch die Buttons Anwenden und OK. Die beiden nächsten Bilder zeigen das Vorgehen:
D) Export des Layers als kml-Datei
Für den folgenden Export erzeugen wir im Projektbereich einen geeigneten Ordner, z.B. \kml-Exporte\.
kml-Dateien sind das typische Geodaten-Austauschformat für Google Earth, vielleicht auch Google Maps. Man kann sie aber auch zum Datenaustausch mit GPS-Empfängern verwenden.
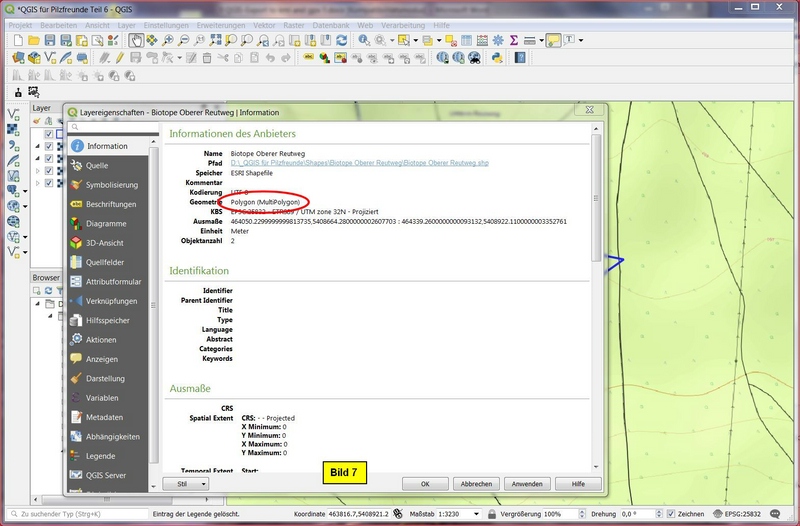
Als Erstes sehen wir uns via Layereigenschaften die Geometrie an. Es handelt sich bei der Darstellung der beiden Biotope um ein Multipolygon:
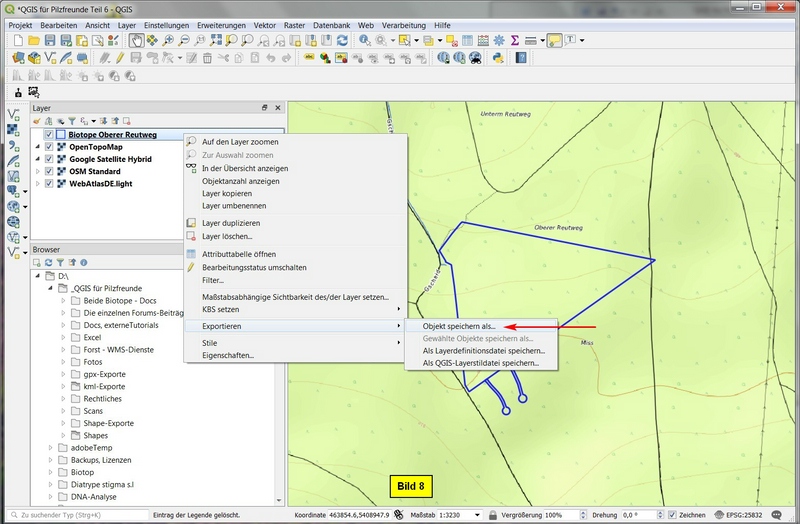
Nun der Export:
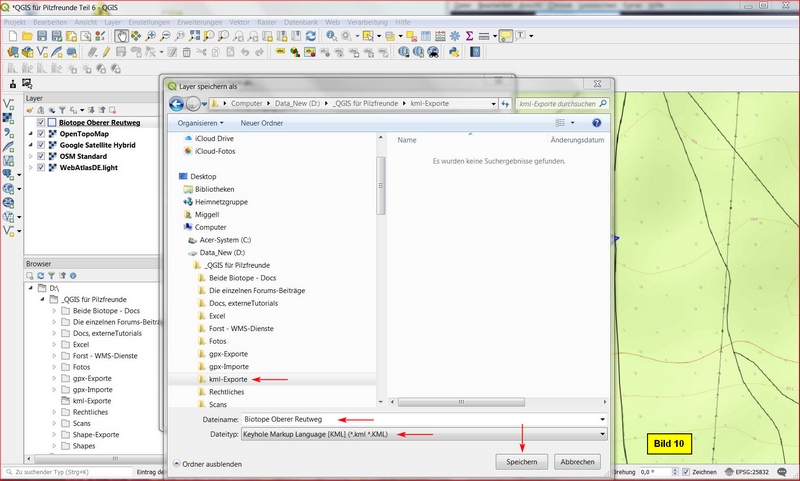
Im Layerfenster den Layer mit ReMT clicken > Exportieren > Speichern als...
Im nächsten Menü Vektorlayer speichern als... clicken wir für den Dateinamen auf den Browse-Button:
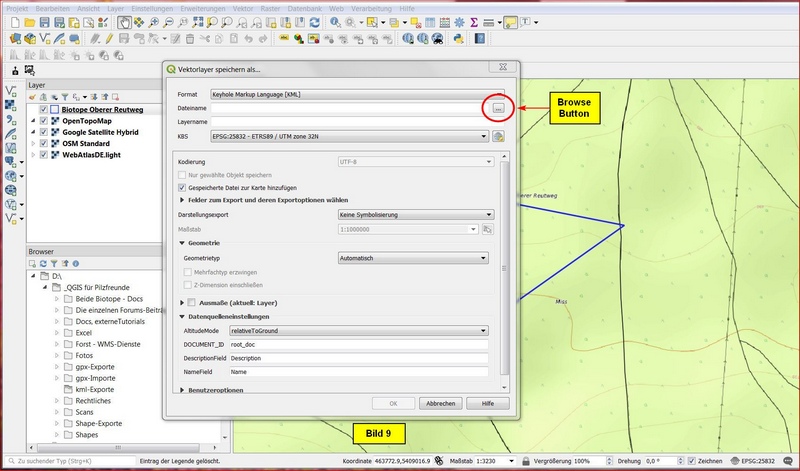
Im Speicher-Menü selektieren wir den für kml-Exporte vorgesehenen Ordner, geben einen geeigneten Dateinamen an und schließen mit Speichern ab.
Zurück im Menü Vektorlayer speichern als... noch mit OK abschließen.
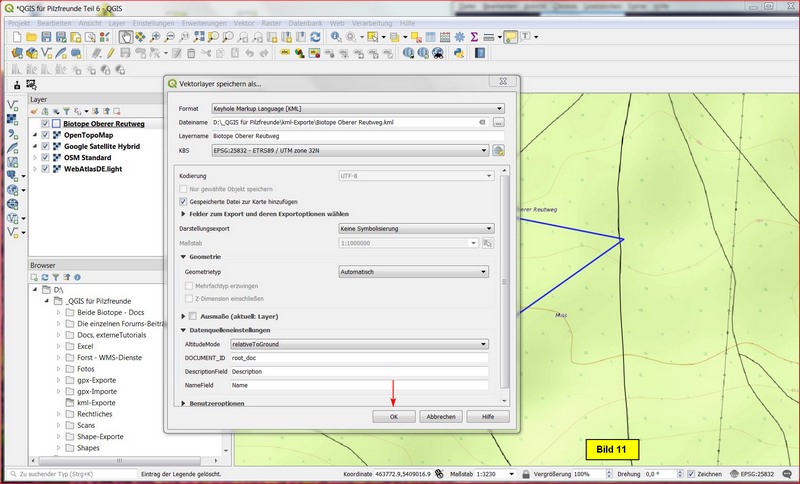
Als Ergebnis wird die kml-Datei generiert, die wir für einen GPS-Empfänger verwenden können.
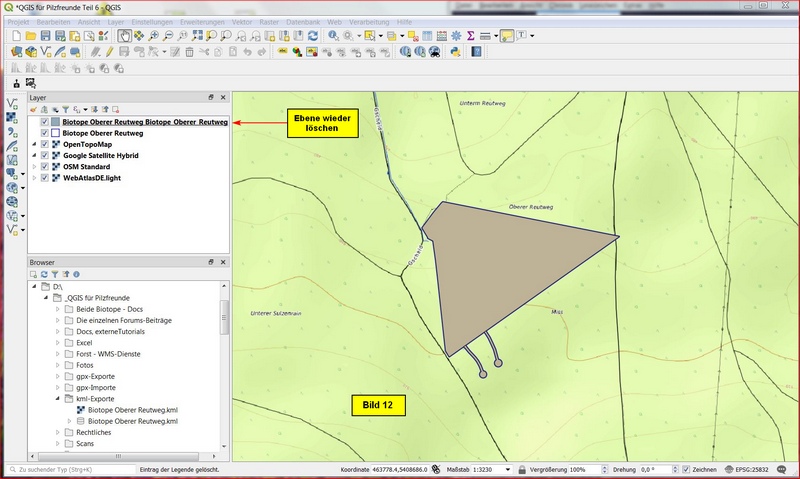
Die in QGIS gleichzeitig generierte Ebene kann wieder gelöscht werden:
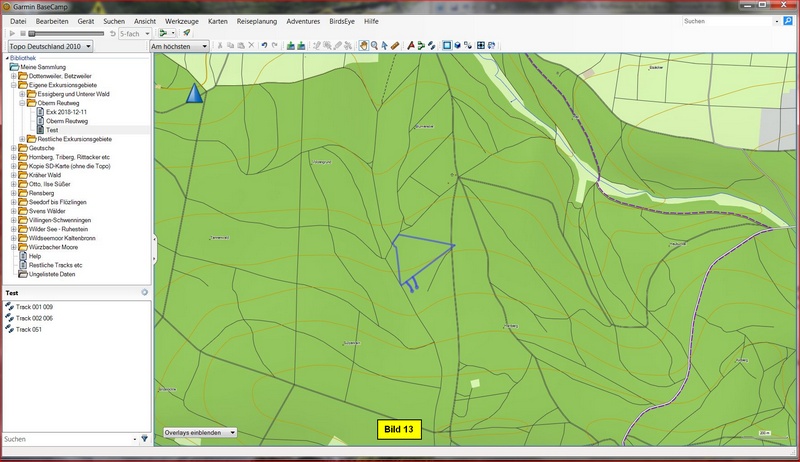
E) kml-Import in GPS-Software
In BaseCamp sieht ein Import unserer kml-Datei dann wie folgt aus:
Notizen
a) Es ist bei einem QGIS-Projekt enorm wichtig, sich die Ordnerstruktur genau zu überlegen! Sie sollte so angelegt sein, dass man die Gesamtheit aller relevanten Dateien (Projektdateien *.qgs sowie alle Datendateien) unter einem gemeinsamen Ordner ansiedelt. Nur so ist ein vernünftiges Backup oder eine Datenübertragung zu einem anderen Rechner möglich. Und noch etwas:
Die Projektdateien *.qgs enthalten selber keine Geodaten, sondern nur die Links. Deshalb Ordner und Datendateien möglichst nicht umbenennen, verschieben etc!!
b) Die exakte Bezeichnung für die UTM-Zone 33 (östlicher Teil Deutschlands) lautet ETRS89 / UTM Zone 33N EPSG:25833.
c) Das Gauss-Krüger-KBS wäre ebenfalls flächentreu und daher für Messungen brauchbar; doch wurde es in den meisten Bundesländern inzwischen durch UTM ersetzt.
Das war’s für heute.
Über einen Daumen nach oben würde ich mich freuen!
Viel Erfolg!
Bernd
Glossar, Abürzungen:
BW – Baden-Württemberg
Georeferenzierung – Objekt (Karte,
Foto...) mit geografischen Koordinaten versehen
DGM (Digitales Geländemodell) - Die reine Geländeoberfläche ohne Bewuchs, ohne Gebäude
ETRS89 / UTM (Universal transverse Mercator) - Flächengetreues KBS in der Einheit Meter, d.h. geeignet zum Messen von Strecken und Flächen
GIS – Geoinformationssystem
Google Maps - Online-Kartendienst
von Google LLC
GPX (GPS eXchange Format) – für
Datenaustausch mit GPS-Empfängern
KBS - Koordinatenbezugssystem
KML (Keyhole Markup Language) - Austauschformat für Geodaten, vorgesehen für Google Earth (aber auch für GPS-Empfänger nutzbar)
KMZ - dasselbe wie KML, lediglich in komprimierter Form
Lidar (Light Detection And Ranging)
LiMT – Linke Maustaste
Open Data – Für jedermann frei
nutzbar zur Verfügung gestellte Daten
OSM – OpenStreetMap
QGIS – Kostenfreies, sehr mächtiges
GIS
ReMT – Rechte Maustaste
Rasterlayer -
Schummerung – Pseudo-3D-Darstellung
durch Schattenwurf
Shape, Shapefile - Datei zum Darstellen von Punkten, Linien und Polygonen (Flächen)
Tiles – Karten min Form von sogen.
„Kacheln“
URL – ein Internet-Link oder die Adresse
einer Website
Vektorlayer - Layer, bestehend aus Vektordaten, d.h. aus Punkten, Linien und Polygonen (Flächen)
WGS 84 EPSG:4326 – globales KBS, bei
GPS-Empfängern verbreitet, nicht zum Messen geeignet
WGS 84/ Pseudo-Mercator EPSG:3857 – globales
KBS für WMS-Einbindungen, nicht zum Messen geeignet
WMS (Web Map Service) –
Internet-Schnittstelle für Landkarten


