Hallo zusammen,
ich möchte Euch hier mal einen Pilz vorstellen, der im Feld erstmal gar nicht auffällt, aber vielleicht trotzdem nicht so selten ist. Es geht um einen Chytridiomyceten, also Töpfchenpilz, der Dacrymyces stillatus befällt. Dabei ist der Pilz nicht wählerisch und nimmt Anamorphe wie auch Teleomorphe als Wirt (dank Anamorphe erkennt man D. stillatus ja auch im Feld schon gut auf Artebene). Beschrieben wurde der Pilz das erste Mal in H. M. Canter, C. T. Ingold, A chytrid on Dacrymyces, Trans. Br. mycol. Soc. 82, 739 (1984). Einen Artikel auf Deutsch gibt es auch: H. Clemençon, M. Wilhelm, Ein parasitischer Winzling in der Zerfliessenden Gallertträne, SZP 95, 20 (2017). Bis jetzt scheint die Art noch nicht wissenschaftlich beschrieben worden zu sein und muß deshalb vorerst unter dem von Canter und Ingold vorgeschlagenem Rhizophlyctis sp. laufen.
Äußerlich sind die befallenen Gallerttränen in keiner Weise verändert:

Mikroskopisch fallen dann aber runde Zellen auf, die eine Reihe haarfeiner Rhizoiden haben, mit denen sie an den Konidien und Hyphen des Wirts andocken. Hier zunächst mal mit Kongorot gefärbt in der Anamorphe:
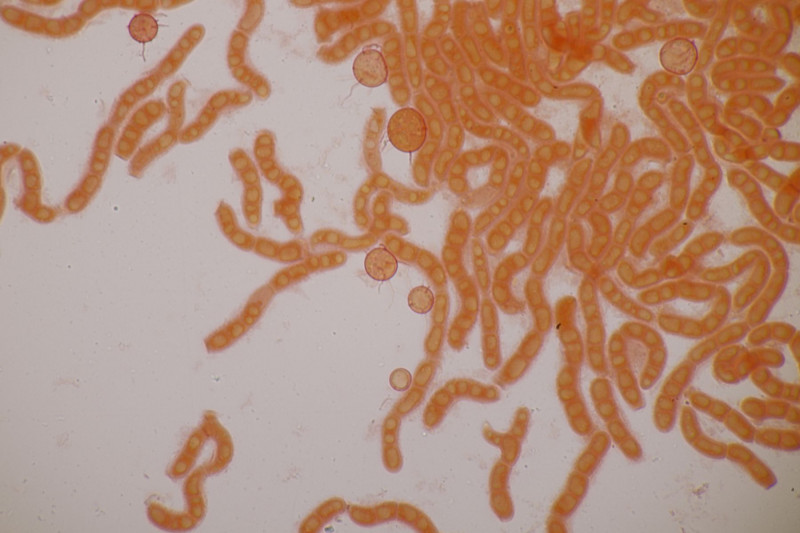


Und in der Teleomorphe:

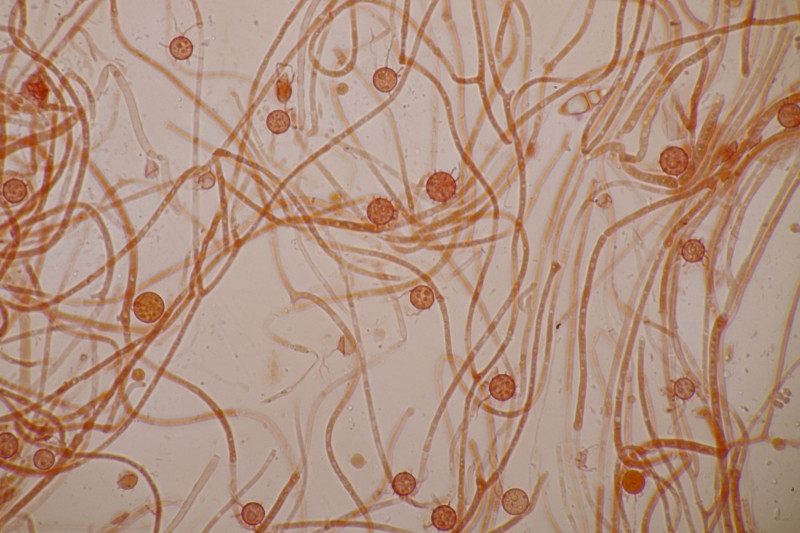

Ohne Färbung einfach in KOH mikroskopiert.
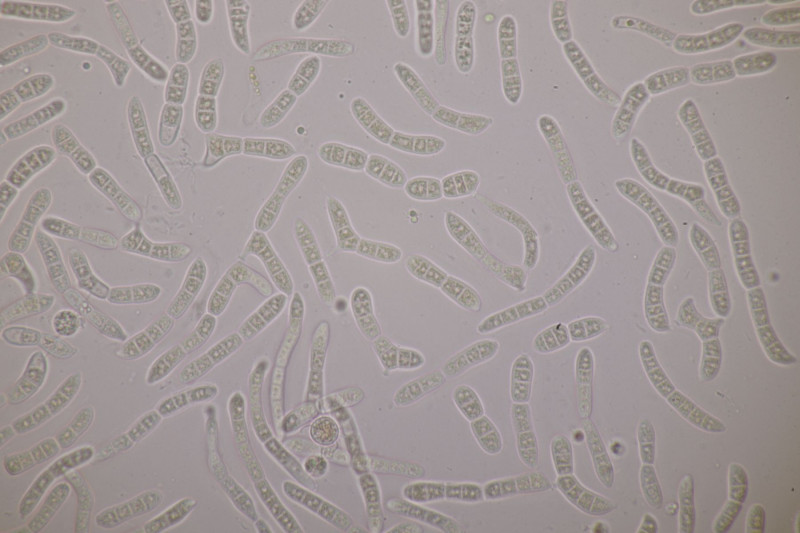



Ich hatte in den letzten Tagen zweimal Aufsammlungen von D. stillatus aus verschiedenen Wäldern mitgenommen, mikroskopiert und den Pilz zweimal gefunden. Ich könnte mir also vorstellen, daß er gar nicht so selten ist - aber wer mikroskopiert schon regelmäßig D. stillatus. Bei beiden Funden waren die Äste mit den Gallertränen direkt auf dem Boden und nicht trockene Äste, die in die Luft ragten. Da Chytridiomyceten ja für ihre Verbreitung auf Feuchtigkeit angewiesen sind, kann das eventuell bei der Suche wichtig sein. Ihr könnt in Euren Gebieten ja auch mal schauen, ob sich der Pilz dort finden läßt.
Björn


