[font="Arial"]27.09.2015: Tolle Arten zwischen Kiefern
Liebe Schwammer-Freunde,
viel Spaß mit diesen etwas älteren Bericht:
Heute war ich mit meiner süßen in einem Kiefernwald unterwegs. Alle Arten zu fotografieren war gar nicht möglich.
Ich zeige Euch ein paar schöne Pilze und was wir so erlebten  [/font]
[/font]
[font="Arial"]Schon vom Auto aus schrie meine Tochter (3 Jahre alt): Papi da sind Schopftintlinge!
Natürlich hielt ich sofort an und meine Tochter kümmerte sich um die Leckerbissen...
Schopftintlinge (Coprinus comatus):

[/font]
[font="Arial"]Ich schaute mir derweilen diese schönen Kameraden an.
Das ist entweder ein Gemeiner Erdritterling (Tricholoma terreum) oder ein Mausgrauer Erdritterling (Tricholoma myomyces).
Den muss ich noch mikroskopieren:

[/font]
[font="Arial"]
[/font]
[font="Arial"]Zum ersten Mal in diesem Jahr fand ich den Blutblättrigen Hautkopf (Cortinarius semisanguineus):[/font]
[font="Arial"]
[/font]
[font="Arial"]Einer der besten Speisepilze in unseren Wäldern ist ganz klar der Orangerote Graustieltäubling (Russula decolorans).
Und davon fanden wir gleich eine ganze Menge - richtig toll:[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Über so viele Leckerbissen freut sich natürlich auch unsere Maus und sammelte fleißig ein:[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Der Kuhröhrling (Suillus bovinus) wuchs überall in großen Scharen:[/font][font="Arial"]
[/font]
[font="Arial"]Ich brachte meine Tochter zu Ihrer Oma - im Garten gab es reichlich Schwärzende Saftlinge (Hygrocybe conica):[/font][font="Arial"]
[/font]
[font="Arial"]Auf der Rückfahrt in den Wald sah ich an einer Birke am Straßenrand etwas...
[/font]
[font="Arial"]Das schaute ich mir näher an...
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, auf Rasen bei Birke
Fundzeit: 27.09.2015
Wuchsform: gesellig
Hutform: jung eiförmig, alt abgeflacht
Huthaut: silbergrau, Flocken grau
Hygrophanität: nein
Hutrand: stark gerieft auf 1/4 des Hutes
Lamellen: weiß
Lamellenschneiden: vergessen zu beurteilen
Lamellen- Hutübergang: vergessen zu beurteilen
Stiel: hellgrau, nicht genattert, hohl
Stielbasis: bräunend, mit Scheide
Fleisch: weiß
Größe: Hutdurchmesser ca. 4-8 cm, Stiellänge ca. 5-15 cm, Stieldurchmesser ca. 12 mm
Sporenpulverfarbe: nicht getestet
Geruch: neutral
Geschmack: nicht getestet
Schmackhafte noch nicht fertig bestimmte Scheidenstreiflinge (Amanita spec.) füllten meinen Korb weiter:

[/font]
[font="Arial"]Daneben der erste unbekannte Cortinarius:
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, auf Rasen bei Birke
Fundzeit: 27.09.2015
Wuchsform: gesellig
Hutform: glockig
Huthaut: violettrosa, glatt, wachsartig
Hygrophanität: nein
Hutrand: eingerollt, mit Cortina
Lamellen: rosabraun
Lamellenschneiden: weiß, gesägt
Lamellen - Hutübergang: angeheftet
Stiel: oben violettlich, nach unten hin weiß werdend, deutliche Abreisszone der Cortina, Mit dicker Reifschicht, hohl
Stielbasis: verdickt keulig
Fleisch: oben violettlich, nach unten hin weiß werdend
Größe: Hutdurchmesser ca. 2-3 cm; Stiellänge ca. 4-7 cm, Stieldurchmesser ca. 10 mm
Sporenpulverfarbe: nicht getestet
Geruch: gut pilzig
Geschmack: nicht probiert
[/font]
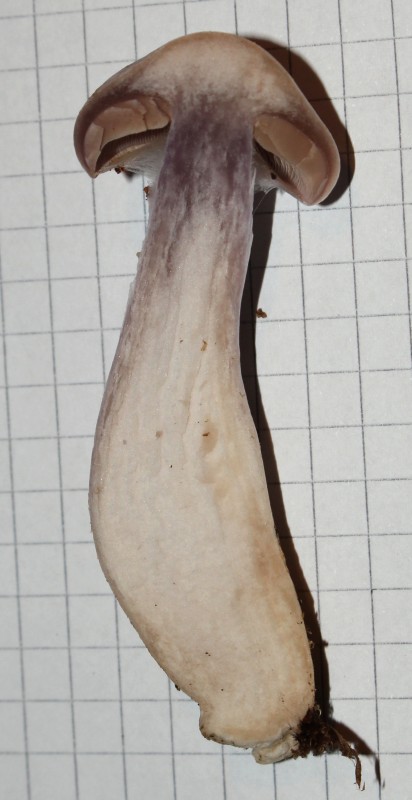
[font="Arial"]Ich versuche diesen noch mikroskopisch zu bestimmen. Vielleicht habt Ihr ja schon einen Tipp...
Unbestimmter Schleierling (Cortinarius spec.):

[/font]
[font="Arial"]
[/font]
[font="Arial"]Im Wald wieder angekommen gab es Grünblättrige Schwefelköpfe (Hypholoma fasciculare) zu sehen und die waren wirklich schön grünlich:


[/font]
[font="Arial"]Der zweite unbekannter Cortinarius heute:
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, auf Rasen neben Nadelwald
Fundzeit: 27.09.2015
Wuchsform: gesellig
Hutform: konvex
Huthaut: braun, leicht faserig, fühlt sich weich an
Hygrophanität: nein
Hutrand: mit Cortina behangen
Lamellen: rosabraun
Lamellenschneiden: weißlich
Lamellen - Hutübergang: angeheftet
Stiel: oben violett mit braunen Fasern, Ringzone, Mitte bräunlich, voll, längsfaserig
Stielbasis: verdickt keulig
Fleisch: creme, oben violettlich
Größe: Hutdurchmesser ca. 3-4 cm; Stiellänge ca. 8-12 cm, Stieldurchmesser ca. 12 mm
Sporenpulverfarbe: nicht getestet
Geruch: etwas fruchtig
Geschmack: nicht probiert
[/font]
[font="Arial"]Ich versuche auch hier noch mikroskopisch etwas zu bestimmen.
Unbestimmter Schleierling (Cortinarius spec.):

[/font]
[font="Arial"]
[/font]
[font="Arial"]Überall gab es echte Prachtstücke vom Flockestieligen Hexenröhrling (Neoboletus luidiformis):

[/font]
[font="Arial"]Der nächste...
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, an Kiefernstumpf
Fundzeit: 27.09.2015
Wuchsform: gesellig
Oberfläche: orangebraun, fellartig, transparent-gelbliche Tropfen sind zu erkennen
Fleisch: weiß bis graulich bis bräunlich, sehr saftig, weich
Größe: 3-15 cm breit
Geruch: muffig stinkend
Geschmack: nicht probiert
[/font]
[font="Arial"]Und das ist der Polsterpilz (Ptychogaster albus):

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Und noch ein toller Scheidenstreifling:
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, aus Kiefernstumpf heraus wachsend im Nadelwald
Fundzeit: 27.09.2015
Wuchsform: einzeln
Hutform: stumpfkegelig
Huthaut: grau, nach außen hin heller werdend, keine Flocken
Hygrophanität: nein
Hutrand: stark gerieft auf 1/3 des Hutes
Lamellen: weiß
Lamellenschneiden: weiß beflockt
Lamellen- Hutübergang: vergessen zu beurteilen
Stiel: weiß, nicht genattert, bereift
Stielbasis: mit Scheide
Fleisch: weiß
Größe: Hutdurchmesser ca. 8 cm, Stiellänge ca. 15 cm, Stieldurchmesser ca. 12 mm
Sporenpulverfarbe: nicht getestet
Geruch: nicht getestet
Geschmack: nicht getestet
[/font]
[font="Arial"]Ebenso noch nicht fertig bestimmter Scheidenstreifling (Amanita spec.):

[/font]
[font="Arial"]Noch eine andere Art Täublinge gab es.
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, im Kiefernwald
Fundzeit: 27.09.2015
Wuchsform: paarweise
Hutform: flach, in der Mitte vertieft, Rand wellig
Huthaut-Konsitenz: glatt, etwas klebrig
Huthaut-Farbe: ockergelb
Huthaut-Abziehbarkeit: 1/2 abziehbar
Fleischfarbe unter Huthaut: weiß
Hut-Fraßstellen-Rand-Verfärbung: weiß
Hutrand: nicht gerieft
Lamellen: creme, keine Zwischenlamellen, viele Y-Gabeln, mit Queradern
Lamellensprödigkeit: sehr spröde
Lamellenschneiden: normal
Lamellen-Hutübergang: gerade angewachsen, nicht herablaufend
Stiel: weiß, etwas bräunlich, leicht keulig, innen voll
Stielbasis: leicht knollig
Fleisch: weiß
Größe: Hutdurchmesser 6-9 cm; Stiellänge 7-10 cm, Stieldurchmesser 15 mm
Sporenpulverfarbe: nicht getestet
Geruch: neutral, nicht nach Obst
Geschmack: minimal schärflich
[/font]
[font="Arial"]Vorab mal als Ocker-Täubling (Russula ochroleuca) vorbestimmt.
Mikroskopische Bestätigung folgt.

[/font]
[font="Arial"]Der nächste Pilz ist mir noch etwas rätselhaft:
Fundort: ca. 550 müNN. ca. N50, O12, auf Nadelholz-Stumpf
Fundzeit: 27.09.2015
Wuchsform: büschelig
Hutform: halbkugelig
Huthaut: rotbraun, minimal befasert
Hygrophanität: nicht festgestellt
Hutrand: etwas eingerollt
Lamellen: gelb, mit Zwischenlamellen
Lamellenschneiden: minimal beflockt
Lamellen - Hutübergang: gerade angewachsen
Stiel: rotbraun, nach unten hin dunkler werdend, stark bereift
Stielbasis: weißfilzig
Fleisch: fest
Größe: Hutdurchmesser ca. 2-3 cm; Stiellänge ca. 3-6 cm, Stieldurchmesser ca. 5 mm
Sporenpulverfarbe: nicht getestet
Geruch: pilzig
Geschmack: bitter
[/font]
[font="Arial"]Das könnte evtl. der Rotbraune Flämmling (Gymnopilus picreus) sein - aber hier muss später noch das Mikroskop ran:

[/font]
[font="Arial"]
[/font]
[font="Arial"]Und schon wieder ein unbekannter Cortinarius:
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, im Nadelwald
Fundzeit: 27.09.2015
Wuchsform: paarweise
Hutform: konvex, leicht glockig
Huthaut: orangebraun, rand cremeweiß, schmierig
Hygrophanität: ja
Hutrand: cremeweiß, mit leichtem braunen Behang, leicht eingerollt
Lamellen: orangecreme, mit Zwischenlamellen
Lamellenschneiden: wellig gesägt
Lamellen - Hutübergang: angeheftet
Stiel: creme, braune faserige Ringzone, voll, längsfaserig
Stielbasis: keulig verdickt und spitz zulaufend
Fleisch: gelblich
Größe: Hutdurchmesser ca. 3,5 cm; Stiellänge ca. 6 cm, Stieldurchmesser ca. 10 mm
Sporenpulverfarbe: nicht getestet
Geruch: neutral
Geschmack: nicht probiert
[/font]
[font="Arial"]evtl. der Bitterste Schleimfuß (Cortinarius vibratilis) - aber noch sehr unsicher:

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Dann wieder etwas ganz leckeres - wie der Name schon verrät: Edelreizker (Lactarius deliciosus):

[/font]
[font="Arial"]Noch ein Täubling - es reißt heut gar nicht ab...
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, im Nadelwald
Fundzeit: 27.09.2015
Wuchsform: einzeln
Hutform: konvex
Huthaut-Konsitenz: glatt, trocken
Huthaut-Farbe: weinrot, hellfleckig
Huthaut-Abziehbarkeit: 1/2 abziehbar
Fleischfarbe unter Huthaut: creme
Hut-Fraßstellen-Rand-Verfärbung: keine
Hutrand: gerieft, Huthaut hochgezogen
Lamellen: creme, starke Queradern, dicht stehend, am Stiel gegabelt
Lamellensprödigkeit: spröde
Lamellenschneiden: normal
Lamellen-Hutübergang: gerade angewachsen, leicht herablaufend
Stiel: weiß, dick
Stielbasis: rund
Fleisch: weiß
Größe: Hutdurchmesser 9 cm; Stiellänge 6 cm, Stieldurchmesser 20 mm
Sporenpulverfarbe: nicht getestet
Geruch: neutral
Geschmack: mild (auch nach längerem Kauen)
[/font]
[font="Arial"]Vorab mal als Braunroter Ledertäubling (Russula integra) vorbestimmt.
Mikroskopische Klärung folgt.

[/font]
[font="Arial"]
[/font]
[font="Arial"]Ein weiterer guter Speisepilz... den wenige mitnehmen (gut für mich ;-): Der Blaustielschleimfuß (Cortinarius collinitus):

[/font]
[font="Arial"]Ich kam an einen Weg auf dem einige Pferdeäpfel lagen.
Auf einem wuchs dieser:
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, auf Pferdeapfel
Fundzeit: 27.09.2015
Wuchsform: paarweise
Hutform: konvex bis glockig
Huthaut: rotbraun
Hygrophanität: ja
Hutrand: kantig
Lamellen: braun
Lamellenschneiden: normal
Lamellen- Hutübergang: frei
Fleisch: braun
Stiel: rotbraun, längsrillig breift, hohl
Stielbasis: normal
Größe: Hutdurchmesser ca. 1-2 cm; Stiellänge 4-7 cm, Stieldurchmesser ca. 1,5 mm
Sporenpulverfarbe: nicht getestet
Geruch: muffig
Geschmack: nicht probiert
[/font]
[font="Arial"]Noch unbestimmter Düngerling (Panaeolus spec.):

[/font]
[font="Arial"]Dann ein Hörnling:
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, an Nadelholzstumpf
Fundzeit: 27.09.2015
Wuchsform: gesellig
Oberfläche: orange, Spitzen rötlich
Fleisch: orange, gummiartig
Größe: bis 1,5 cm lang
Geruch: neutral
Geschmack: nicht probiert
[/font]
[font="Arial"]Mattias half mir hier - das ist der Gegabelte Nadelholz-Hörnling (Calocera furcata):

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Als ich zuhause war merkte ich dass sich noch eine weitere Art Täubling in meinem Korb versteckte:
[/font]
[font="Arial"]Fundort: ca. 550 müNN. ca. N50, O12, im Nadelwald
Fundzeit: 27.09.2015
Wuchsform: einzeln
Hutform: konvex
Huthaut-Konsitenz: glatt
Huthaut-Farbe: orangerot mit Olivetönen
Huthaut-Abziehbarkeit: 1/2 abziehbar
Fleischfarbe unter Huthaut: orangerosalich
Hut-Fraßstellen-Rand-Verfärbung: keine
Hutrand: leicht gerieft
Lamellen: weiß, ein paar Zwischenlamellen, nicht gegabelt, keine Queradern
Lamellensprödigkeit: spröde
Lamellenschneiden: normal
Lamellen-Hutübergang: gerade angewachsen, etwas herablaufend
Stiel: weiß, etwas rötlich überhaucht, innen etwas wattig ausgestopft
Stielbasis: rund
Fleisch: weiß
Größe: Hutdurchmesser 6-9 cm; Stiellänge 7-10 cm, Stieldurchmesser 15 mm
Sporenpulverfarbe: nicht getestet
Geruch: nicht getestet
Geschmack: mild (auch nach längerem Kauen)
[/font]
[font="Arial"]Das ist evtl. ein Purpurbrauner Ledertäubling (Russula vinosobruenna) - aber auch hier werde ich noch das Mikroskop anwerfen:

[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]
[/font]
[font="Arial"]Später machte ich dann mal wieder einen Geschmackstest.
Die Reizker brate ich komplett. Ihr solltet die nicht zerstückeln, da in der Milch der gute Geschmack steckt.
Ebenso schmecken Reizker nicht bitter wenn sie gebraten sind, sondern saugut.
So sieht das dann aus - links ein Edelreizker, rechts das sind Fichtenblutreizker:

[/font]
[font="Arial"]...mmmmhm. Wer das mal probiert hat der wird immer wieder davon haben wollen 
[/font]
[font="Arial"]OK, also wie versprochen mein Geschmackstest (separat gebratene Pilze) von heute:
[/font]
[font="Arial"]Geschmacksbewertung:
Hier die Sieger der Reihe nach geordnet (1 = mies, 10 = das Beste was es gibt):
Fichtenblutreizker: 9,5
Edelreizker: 9,0
Orangeroter Graustieltäubling: 8,5
Netzstieliger Hexenröhrling: 8
[/font]
[font="Arial"]Sicher ist das Geschmacks-Sache. Weitere Geschmacksbewertungen folgen bald.
[/font]
[font="Arial"]Ich hoffe mein Bericht hat Euch gefallen und freue mich über Eure Kommentare.
Beste Grüße
Dieter
[/font]
![]()


